zasićena otopina → saturated solution
Zasićena otopina je otopina koja sadrži maksimalno moguću količinu otopljene tvari. Kada je otopina zasićena, postignuto je stanje ravnoteže jer je brzina otapajnja čvrste tvari i brzina rekristalizacije ista. Količina tvari koja se može otopiti varira s temperaturom; hladne otopine obično sadrže manje otopljene tvari nego vruće otopine. Plinovi su topljiviji u hladnim nego u vrućim tekućinama.
Koncentracija tvari u takvoj zasićenoj otopini naziva se topljivošću te tvari pri danoj temperaturi.
salinitet → salinity
Salinitet (S) je mjera za količinu otopljenih soli u morskoj vodi. Salinitet je definiran kao ukupna količina otopljenih soli u morskoj vodi u promilima, ‰, (djelovima na tisuću) kada se svi karbonati pretvore u okside, bromidi i jodidi u kloride i kada se sve organske tvari kompletno oksidiraju.
Klorinitet je najstarija metoda za mjerenje saliniteta koja, temeljem ideje o stalnom omjeru otopljenih komponenti morske vode, pruža uvid u ukupnu količinu otopljenih soli u morskoj vodi mjerenjem koncentracije halida (klorida, bromida i jodida). Odnos između kloriniteta (Cl) i saliniteta dan u Knudsenovim tablicama jest
Ova formula koristila se do 1962., kada je JPOTS (Joint Panel for Oceanographic Tables and Standards) odredilo novu konstantu proporcionalnosti u Knudsenovoj formuli
U međuvremenu, razvoj uređaja za mjerenje električne vodljivosti doveo je do brze, jeftine i precizne metode za određivanja slanosti morske vode. Uveden je Praktični salinitet (SP) kao zamjena za salinitet dobiven mjerenjem kloriniteta. Skala praktičnog saliniteta (Practical Salinity Scale 1978, PSS-78) definirana je preko K15, odnosno odnosa električne vodljivosti uzorka mora pri t68 = 15 °C i tlaku od jedne standardne atmosfere i otopine kalijevog klorida (KCl) u kojoj je maseni udio KCl točno 0.0324356 (32.4356 g KCl otopljeno je u 1 kg otopine) pri istom tlaku i temperaturi.
Praktični salinitet je bezdimenzijska veličina iako mu ponekad (pogrešno) pripisuju jedinicu "psu". U većini slučajeva može se pretpostaviti da su psu i ‰ sinonimi.
Prosječni salinitet morske vode je 35 ‰, što je oko 35 g soli otopljeno u 1 kg morske vode.
more → seawater
More, odnosno morska voda, nezasićena je homogena otopina koja se sastoji od vode kao otapala (96.5 %) i otopljenih soli (3.5 %) te manjih količina partikularne tvari, otopljenih plinova i organskih sastojaka. Veći dio Zemlje pokriven je morskom vodom. Od ukupne površine Zemlje (510 100 000 km2) svjetski oceani prekrivaju skoro 71 % (361 840 000 km2) s prosječnom dubinom od 3 682.2 m.
Gustoća morske vode je, zbog njene slanosti, viša od one čiste vode. Uz to, povećanjem slanosti vode snižava se temperatura ledišta a povisuje temperatura vrelišta mora. Prosječna slanost oceana je 35 ‰, što iznosi oko 35 g čvrste tvari otopljene u 1 kg morske vode. Ispitivanjem koncentracija najzastupljenijih soli u moru utvrđeno je da je njihov relativan odnos u moru konstantan bez obzira na njihovu apsolutnu količinu. Samo šest elemenata i spojeva čine oko 99 % otopljenih soli u moru: klorid (Cl-), natrij (Na+), sulfat (SO42-), magnezij (Mg2+), kalcij (Ca2+) i kalij (K+).
poluvodič → semiconductor
Polumetali kao što su silicij ili germanij slabo vode električnu struju, ali porastom temperature raste njihova vodljivost. Vodljivost poluvodiča može se znatno povećati (oko 50 puta) ako se onečiste (dopiraju) malom količinom stranih atoma. Zamijeni li se atom silicija atomom 15. skupine (P, As, Sb) koji imaju jedan valentni elektron više od silicija, nastat će n-tip poluvodiča. Zamijeni li se atom silicija atomom 13. skupine (Al, Ga, In) koji imaju jedan valentni elektron manje od silicija, nastat će p-tip poluvodiča.
topljivost → solubility
Topljivost je najveća količina neke tvari koja se može otopiti u nekoj količini otapala pri određenoj temperaturi. Općenito, topljivost čvrstih tvari u tekućinama raste s temperaturom a topljivost plinova opada. Topljivost se obično izražava masom otopljene tvari po masi otopine (maseni udio), molnim udjelom otopljene tvari, molalitetom, koncentracijom, i drugim.
standardni elektrodni potencijal → standard electrode potential
Standardni elektrodni potencijal (E°) (standardni redukcijski potencijl) definiran je mjerenjem relativnih elektrodnih potencijala uz standardne uvjete (aktivitet 1, tlak 101 325 Pa i temperatura 25 °C) prema standardnoj vodikovoj elektrodi. Po konvenciji članak se piše tako da se oksidirani oblik piše prvi. Na primjer,
Elektromotorna sila gornjeg članka je -0.76 V pa je standardni elektrodni potencijal Zn2+|Zn polućelije -0.76 V.
Kada su aktiviteti oksidiranog i reduciranog oblika jednaki 1, tada je logaritamski član u Nernstovoj jednadžbi za elektrodni potencijal jednak nuli i imamo
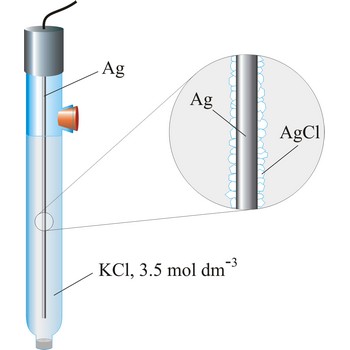
srebro/srebrov klorid elektroda → silver/silver-chloride electrode
Srebro/srebrov klorid elektroda je najčešće korištena referentna elektroda zbog svoje jednostavnosti, neotrovnosti, niske cijene i stabilnosti. Najčešći se puni zasićenim kalijevim kloridom ali može biti punjena i kalijevim kloridom nižih koncentracija, npr. 3.5 mol dm-3 ili 1 mol dm-3. Rad srebro/srebrov klorid elektrode temelji se na polureakciji
Tablica: Ovisnost potencijala srebro/srebrov klorid elektrode o temperaturi i koncentraciji KCl prema standardnoj vodikovoj elektrodi
| potencijal prema SHE / V | ||
|---|---|---|
| t / °C | 3.5 mol dm-3 | zasić. otop. |
| 15 | 0.212 | 0.209 |
| 20 | 0.208 | 0.204 |
| 25 | 0.205 | 0.199 |
| 30 | 0.201 | 0.194 |
| 35 | 0.197 | 0.189 |
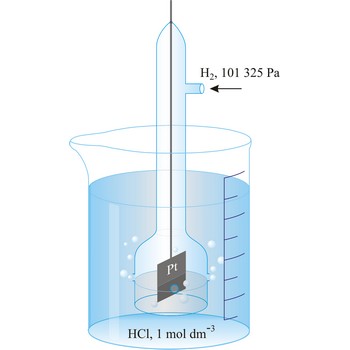
standardna vodikova elektroda → standard hydrogen electrode
Standardna vodikova elektroda sastoji se od elektrode od spužvaste platine uronjene u otopinu vodikovih iona aktiviteta 1 kroz koju se propušta plinoviti vodik pod tlakom od 101 325 Pa. Standardna vodikova elektroda u članku dogovorno se prikazuje uvijek lijevo
Redoks-potencijal standardne vodikove elektrode, pri svim temperaturama, dogovorno je uzet kao 0.
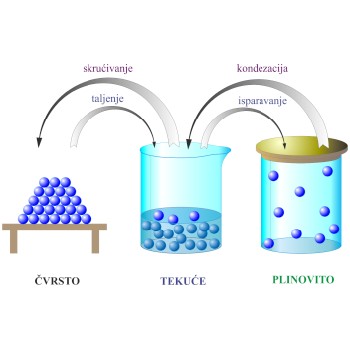
agregatno stanje → state of matter
Agregatno stanje je naziv za oblike u kojima se može pojaviti materija. Razlikuju se tri agregatna stanja: čvrsto, tekuće i plinovito. Zagrijavanjem prelazi čvrsta tvar na temperaturi tališta u tekućinu. Zagrijavamo li tekućinu i dalje, na temperaturi vrelišta ona prelazi u plinovito stanje - paru.
stratosfera → stratosphere
Stratosfera je dio Zemljine atmosfere koji se proteže od vrha troposfere (obično od 10 km do 15 km iznad površine) do oko 50 km. Karakterizirana je povećanjem temperature s povećanjem visine.
Citiranje ove stranice:
Generalić, Eni. "Critical temperature." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav