more → seawater
More, odnosno morska voda, nezasićena je homogena otopina koja se sastoji od vode kao otapala (96.5 %) i otopljenih soli (3.5 %) te manjih količina partikularne tvari, otopljenih plinova i organskih sastojaka. Veći dio Zemlje pokriven je morskom vodom. Od ukupne površine Zemlje (510 100 000 km2) svjetski oceani prekrivaju skoro 71 % (361 840 000 km2) s prosječnom dubinom od 3 682.2 m.
Gustoća morske vode je, zbog njene slanosti, viša od one čiste vode. Uz to, povećanjem slanosti vode snižava se temperatura ledišta a povisuje temperatura vrelišta mora. Prosječna slanost oceana je 35 ‰, što iznosi oko 35 g čvrste tvari otopljene u 1 kg morske vode. Ispitivanjem koncentracija najzastupljenijih soli u moru utvrđeno je da je njihov relativan odnos u moru konstantan bez obzira na njihovu apsolutnu količinu. Samo šest elemenata i spojeva čine oko 99 % otopljenih soli u moru: klorid (Cl-), natrij (Na+), sulfat (SO42-), magnezij (Mg2+), kalcij (Ca2+) i kalij (K+).
značajne znamenke → significant figures
Mjerenja nikad nisu beskrajno točna i mora se procijeniti mjera njihove neizvjesnosti. U nekom podatku mjerenja sve sigurne i prva nesigurna znamenka značajne su.
Pravila za određivanje značajnih znamenki jesu:
- Sve nule na početku broja zanemaruju se
- Sve nule na kraju broja zanemaruju se osim ako nisu iza decimalnog zareza
- Sve ostale znamenke, uključujući nulu između brojaka koje nisu nule, značajne su
Tako npr. broj
| 0.0023 | ima dvije značajne znamenke |
| 0.109 | ima tri značajne znamenke |
| 2.00 | ima tri značajne znamenke |
| 70 | ima jednu značajnu znamenku |
Rezultat treba imati samo značajne znamenke.
Prilikom zbrajanja i oduzimanja rezultat može imati onoliko znamenki iza decimalnog zareza koliko ih ima podatak s najmanjim brojem decimala (s najvećom apsolutnom pogreškom).
U množenju i dijeljenju rezultat treba imati onoliko značajnih znamenki koliko ih ima podatak s najmanjim brojem značajnih znamenki (s najvećom relativnom pogreškom). Ovo pravilo valja primijeniti s oprezom.
U logaritmu broja zadrži se onoliko znamenki desno od decimalnog zareza koliko je značajnih znamenki u izvornom broju
U antilogaritmu broja zadrži se onoliko znamenki koliko je znamenki desno od decimalnog zareza u izvornom broju.
jednostavna kubična rešetka → simple cubic lattice
Jednostavna ili primitivna kubična rešetka (označava se sa sc ili P) ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije. Kristalografski vektori jedinične ćelije su a = b = c a kutovi među njima α=β=γ=90°.
Najjednostavnija kristalna struktura jeste ona koja ima po jedan atom u svakom čvoru jedinične ćelije. Jediničnoj ćeliji pripada jedan atom (8×1/8 = 1), a atomi popunjavaju 52 % volumena kocke. Samo jedan metal (α-polonium) kristalizira u kubičnom sustavu s jednostavnom rešetkom.
lupa → simple magnifier
Lupa je bikonveksna leća, smještena između predmeta i oka, ali unutar žarišne daljine leće. Kutno povećanje lupe dano je izrazom:
u kojem je f žarišna daljina leće a 15 cm uzima se kao daljina jasnog vida normalnog oka. Slika predmeta je virtualna, jer ne nastaje u sjecištu zraka nego u sjecištu produžetaka zraka. Takva se slika ne može oslikati na zastoru (poput slike u zrcalu).
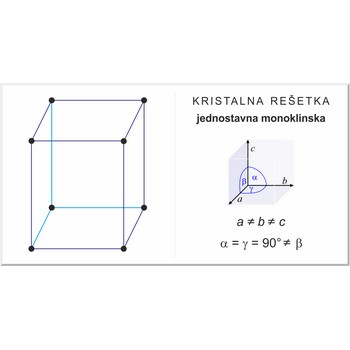
jednostavna monoklinska rešetka → simple monoclinic lattice
Jednostavna ili primitivna monoklinska rešetka (označava se sa P) ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije. Kristalografski vektori jedinične ćelije su a≠b≠c a kutovi među njima α=γ=90°≠β.
jednostavna ortorompska rešetka → simple orthorhombic lattice
Jednostavna ili primitivna ortorompska rešetka (označava se sa P) ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije. Kristalografski vektori jedinične ćelije su a≠b≠c a kutovi među njima α=β=γ=90°.
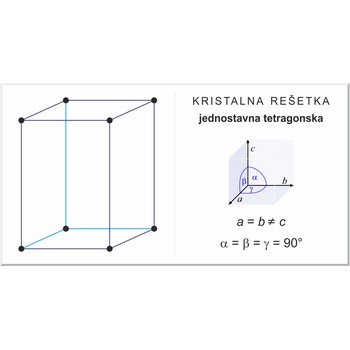
jednostavna tetragonska rešetka → simple tetragonal lattice
Jednostavna ili primitivna tetragonska rešetka (označava se sa P) ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije. Kristalografski vektori jedinične ćelije su a=b≠c kutovi među njima α=β=γ=90°.
sp3 hibridna orbitala → sp3 hybrid orbital
sp3 hibridna orbitala jest orbitala nastala linearnom kombinacijom jedne s i tri p orbitale usporedive energije (kao što su 2s i 2p orbitale) u istom atomu. Četiri sp3 hibridne orbitale usmjerene su prema uglovima tetraedra i međusobno zatvaraju kut od 109.5°.
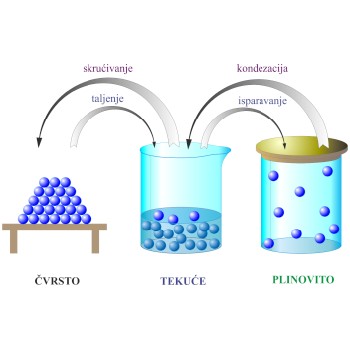
agregatno stanje → state of matter
Agregatno stanje je naziv za oblike u kojima se može pojaviti materija. Razlikuju se tri agregatna stanja: čvrsto, tekuće i plinovito. Zagrijavanjem prelazi čvrsta tvar na temperaturi tališta u tekućinu. Zagrijavamo li tekućinu i dalje, na temperaturi vrelišta ona prelazi u plinovito stanje - paru.
superkritični fluid → supercritical fluid
Superkritični fluid je bilo koja tvar iznad svoje kritične temperature i kritičnog tlaka (vidi fazni dijagram). On ima jedinstvena svojstva koja se razlikuju i od plinova i od tekućina. Superkritični fluid ima svojstvo plina da penetrira u svaku poru kao i svojstvo tekućine da otapa materijale. Topljivost tvari raste s porastom gustoće (tj. s porastom tlaka). Primjerice, naftalen je praktički netopiv u niskotlačnom tekućem ugljičnom dioksidu. Na 100 bar topljivost je 10 g/L a na 200 bar je 50 g/L. Brzom ekspanzijom superkritične otopine dolazi do taloženja otopljene krutine.
Citiranje ove stranice:
Generalić, Eni. "Critical point." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav