Avogadrova konstanta → Avogadro constant
Avogadrova konstanta (L ili NA) odnos je broja jedinki (N) i količine tvari (n).
Mjerenjem difrakcije rendgenskih zraka na kristalima nađeno je da Avogadrova konstanta (L) ima vrijednost
L = (6.022 045±0.000 031)×1023 mol-1.
Boltzmannova jednadžba → Boltzmann equation
Boltzmannova jednadžba predstavlja statističku definiciju entropije:
S je entropija, k je Boltzmanova konstanta, a W je vjerojatnost postojanja sustava u pojedinom stanju.
Boudouardova ravnoteža → Boudouard’s equilibrium
Ravnoteža koja se uspostavlja kod reakcije ugljikova(IV) oksida s ugljikom naziva se Boudouardova ravnoteža. Zbog endotermnosti reakcije povećanje temperature pomiče reakciju udesno a sniženje temperature ulijevo.
kiselina → acid
Kiseline su vrsta spojeva koji sadrže vodik i disocijacijom u vodi daju pozitivne vodikove ione pri čemu je rezultirajući pH manji od 7. Reakcija za kiselinu HA može se napisati kao
Ustvari, vodikov je ion (proton) solvatiziran pa reakcija disocijacije kiseline izgleda ovako:
Ova definicija kiselina dolazi iz Arrheniusove teorije. Kiseline su tvari čije vodene otopine imaju kiseli okus, korozivne su i mijenjaju boju lakmus-papira u crvenu.
Kiseline možemo podijeliti na jake, koje potpuno disociraju u vodi (npr. sulfatna i kloridna kiselina), i slabe kiseline, koje su samo djelomično disocirane (npr. octena i sumporvodična kiselina). Jakost kiseline ovisi o stupnju disocijacije i izražava se konstantom disocijacije kiseline.
Arrheniusovu definiciju kiselina i baza proširili su J. M. Lowry i J. N. Brønsted 1923. Njihova teorija definira kiselinu kao tvar koja daje proton (proton donor), a bazu kao tvar koja je sposobna primiti proton (proton akceptor). Da bi se neka jedinka ponašala kao kiselina, mora biti prisutan proton akceptor (baza). Lowry-Brønstedova teorija kaže da kad neka kiselina dade proton, nastane konjugirana baza koja može primiti proton.
Prema Lowry-Brønstedovoj predodžbi, kad neka kiselina dade proton, uvijek nastane konjugirana baza koja može primiti proton.
Slično, od svake baze kao rezultat primitka protona nastane konjugirana kiselina.
Primjerice, acetatni ion je konjugirana baza octene kiseline, a amonijev ion je konjugirana kiselina amonijaka.
Što je kiselina konjugiranog kiselo/baznog para slabija, njezina konjugirana baza postaje jača, i obrnuto.
Najopćenitiju definiciju kiselina dao je G. N. Lewis koji sve kemijske vrste koje mogu primiti elektronski par naziva kiselinama. Ova definicija uključuje sve "tradicionalne" kiselo-bazne reakcije, ali sadrži i reakcije koje ne uključuju ione, primjerice
u kojoj je NH3 baza (donor elektronskog para) a BCl3 kiselina (akceptor elektronskog para).
Bravaisova rešetka → Bravais lattice
Bravaisova rešetka je beskrajni niz zasebnih točaka čiji se raspored i orijentacija ponavlja iz koje god točke niza se gledalo. Francuski kristalograf Auguste Bravais (1811.-1863.) ustanovio je da se u prostoru mogu konstruirati samo četrnaest različitih prostornih rešetki. Svi kristalni materijali mogu se uklopiti u jedan od ovih rasporeda.
|
Kristalni sustav
|
Bravaisove kristalne rešetke
|
|||
|
kubični a=b=c α=β=γ=90° |
 |
 |
 |
|
|
|
jednostavna kubična
|
prostorno centrirana kubična
|
plošno centrirana kubična
|
|
|
tetragonski a=b≠c α=β=γ=90° |
 |
 |
||
|
|
jednostavna tetragonska
|
prostorno centrirana tetragonska
|
||
|
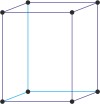
ortorompski a≠b≠c α=β=γ=90° |
 |
 |
 |
 |
|
|
jednostavna ortorompska
|
bazno centrirana ortorompska
|
prostorno centrirana ortorompska
|
plošno centrirana ortorompska
|
|
monoklinski a≠b≠c α=γ=90°≠β |
 |
 |
||
|
|
jednostavna monoklinska
|
bazno centrirana monoklinska
|
||
|
heksagonski a=b≠c α=β=90° γ=120° |
 |
|||
|
|
heksagonska
|
|||
|
romboedarski a=b=c α=β=γ≠90° |
 |
|||
|
|
romboedarska
|
|||
|
triklinski a≠b≠c α≠β≠γ≠90° |
 |
|||
|
triklinska
|
||||
Bronsted-Lowryeva teorija kiselina i lužina → Bronsted-Lowry’s acid-base theory
Brønsted-Lowryeva teorija kiselina i lužina: Kiselina je tvar koja daje proton (protondonor) a lužina je tvar koja prima proton (protonakceptor).
konverzijski faktor → conversion factor
Konverzijski faktor je odnos između dvije jedinice. Ako neku mjeru pomnožimo konverzijskim faktorom, onda ćemo joj promijeniti jedinicu mjere, npr.
krioskopska konstanta → cryoscopic constant
Krioskopska konstanta (Ef) ili molalno sniženje ledišta jest sniženje ledišta određenog otapala kada je u 1 kg tog otapala otopljen 1 mol neke tvari. Sniženje ledišta razmjerno je molalitetu (m) otopljene tvari
konstanta disocijacije kiseline → acid dissociation constant
Konstanta disocijacije kiseline (Ka) ravnotežna je konstanta za disocijaciju kiseline HA prema reakciji
U praksi se često koristi oznaka p za negativni logaritam konstante disocijacije.
Citiranje ove stranice:
Generalić, Eni. "Clay triangle." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav
