otrov → poison
Otrovi su tvari koje kontaktom ili unošenjem u organizam slabe ili onemogućavaju normalne metaboličke procese i tako mijenjaju normalno funkcioniranje organa ili tkiva
Otrovi su tvari ili molekule koje se skupljaju na površini katalizatora i time blokiraju pristup aktivnim centrima ili uništavaju njihovu aktivnost.
Otrovi su tvari koje apsorbiranjem neutrone i time smanjuju nuklearnu reakciju. Prevelika količina otrova može potpuno zaustaviti lančanu reakciju.
ruthefordij → rutherfordium
Ruthefordij su 1964. godine otkrili djelatnici Berkeley laboratorija (USA) i Nuklearnog istraživačkog centra u Dubni (Rusija). Ime je dobio u čast novozelandskog fizičara Ernesta Rutherforda (1871.-1937.). To je sintetski radioaktivni metal. U Dubni su ruthefordij pripravili bombardiranjem plutonija jezgrama neona-22, a u Berkeleyu bombardiranjem kalifornija jezgrama ugljika-12.
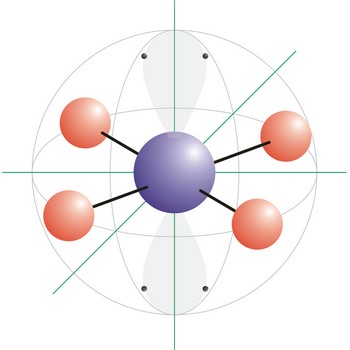
kvadratna planarna geometrija molekule → square planar molecular geometry
Kvadratna planarna geometrija molekule onaj je oblik molekule kod kojeg su četiri veze i dva slobodna elektronska para vezani na centralni atom molekule. Ksenonov tetraflurid (XeF4) primjer je kvadratne građe molekule. Nepodijeljeni elektronski parovi smještaju se u dva nasuprotna vrha oktaedra a fluorovi atomi u preostala četiri tvoreći kvadrat oko ksenona. Oktaedarski raspored elektronskih orbitala posljedica je sp3d2 (ili d2sp3) hibridizacije na centralnom atomu.
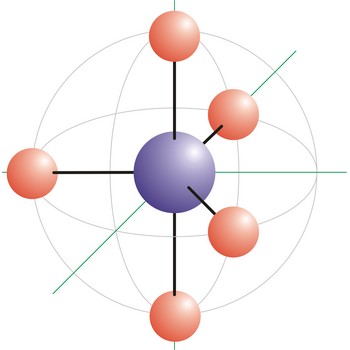
kvadratna piramidalna geometrija molekule → square pyramidal molecular geometry
Kvadratna piramidalna geometrija molekule onaj je oblik molekule kod kojeg su pet veza i jedan slobodan elektronski par vezani na centralni atom molekule. Bromov pentafluorid (BrF5) primjer je molekule koja ima geometriju kvadratne piramide. Smještaj nepodijeljenog elektronskog para potpuno je proizvoljan jer su svih šest elektronskih skupina ekvivalentne. Oktaedarski raspored elektronskih orbitala posljedica je sp3d2 (ili d2sp3) hibridizacije na centralnom atomu.
stereoizomer → stereoisomer
Stereoizomeri su spojevi identične kemijske građe ali različitog rasporeda atoma ili grupa u prostoru. Mogu biti optički (enantiomeri ili zrcalni izomeri) i geometrijski izomeri (cis-trans).
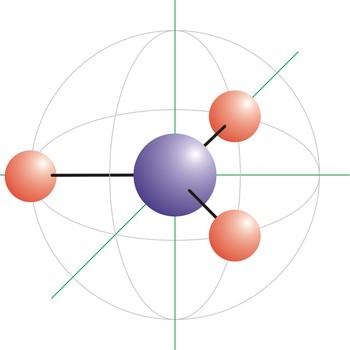
T-oblik geometrije molekule → T-shaped molecular geometry
T-oblik molekule imaju molekule koje oko centralnog atoma imaju tri veze i 2 slobodna elektronska para. Atomi vezani na centralni atom leže na krajevima slova T s kutovima od 90° između njih. Elektronske orbitale usmjerene u vrhove trigonske bipiramide posljedica su sp3d (ili dsp3) hibridizacije na centralnom atomu. ICl3 ima T-oblik molekule.
tetraedarska geometrija molekule → tetrahedral molecular geometry
Tetraedarska geometrija molekule onaj je oblik kod kojeg u molekuli postoje četiri veze na centralnom atomu bez slobodnih elektronskih parova. Atomi vezani na centralni atom leže na vrhovima tetraedra s kutom od 109.5° između njih. Tetraedarski raspored elektronskih orbitala posljedica je sp3 hibridizacije na centralnom atomu. Npr. amonijev ion (NH4+) i metan (CH4) imaju tetraedarsku geometriju molekule.
trigonska bipiramidalna geometrija molekule → trigonal bipyramidal molecular geometry
Trigonska bipiramidalna geometrija molekule oblik je molekule kod kojeg je na centralni atom vezano pet veza bez ijednog slobodnog elektronskog para. Tri veze su raspoređene u ekvatorijalnoj ravnini atoma pod kutom od 120° svaka, a druge dvije su na osi centralnog atoma. Aksijalne veze su pod pravim kutom u odnosu na ekvatorijalne veze. Elektronske orbitale usmjerene u vrhove trigonske bipiramide posljedica su sp3d (ili dsp3) hibridizacije na centralnom atomu. Molekula PCl5 ima trigonsku bipiramidalnu geometriju.
trigonska planarna geometrija molekule → trigonal planar molecular geometry
Trigonska planarna geometrija molekule onaj je oblik kod kojeg su tri veze vezane na centralni atom u molekuli bez ijednog slobodnog para elektrona. Veze su raspoređene u ekvatorijalnoj ravnini s međusobnim kutovima od 120°. Elektronske orbitale usmjerene prema vrhovima trokuta posljedica su sp2 hibridizacije na centralnom atomu. Karbonatni ion (CO32-) ima trigonsku planarnu geometriju molekule.
Citiranje ove stranice:
Generalić, Eni. "Chiral centre." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav