litij → lithium
Litij je 1817. godine otkrio Johan August Arfvedson (Švedska). Ime su mu dali Arfvedson i Berzelius od grčke riječi lithos što znači stijena jer je litij otkriven u stijenama za razliku od druga dva elementa prve skupine, kalija i natrija, koji su dobiveni iz biljnog materijala. To je mekani, srebrno bijeli metal koji sporo reagira s kisikom iz zraka. Može se zapaliti na zraku, a u reakciji s vodom razvija vodik iako manje burno nego natrij. Litij je najjače redukcijsko sredstvo. Rijetko se nalazi u većim koncentracijama. Najčešće se javlja u obliku aluminosilikata kao što je spodumen (LiAlSi2O6). Litij je najlakši metal. Upotrebljava se za legiranje aluminija i za izradu specijalnih stakala i keramike. Zbog svog velikog elektrokemijskog potencijala koristi se kao anoda u baterijama.
indeks života na planetu → living planet index
Indeks života na planetu (LPI, Living Planet Index) odražava stanje ekosustava i njegove bioraznolikosti praćenjem 7953 populacije kralježnjaka (ptica, sisavaca, vodozemaca, gmazova i riba) iz 2544 vrsta. LPI se računa tako da se prvo izračunaju godišnje promjene za svaku populaciju u bazi, a zatim se izračuna prosječna promjena za sve populacije. Od 1970. kad je počelo prikupljanje podataka pa do 2007. godine globalni LPI pokazuje pad od 30 %.
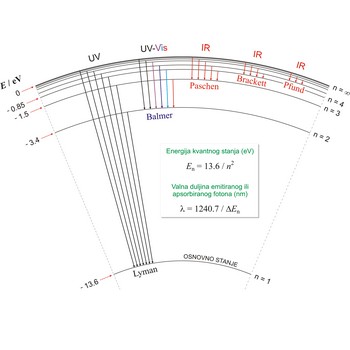
Lymanova serija → Lyman series
Lymanova serija je serija linija u spektru vodikova atoma koja nastaje skokom elektrona iz viših energijskih nivoa u normalno stanje s kvantnim brojem n = 1.
magnezij → magnesium
Magnezij je 1808. godine otkrio Sir Humphry Davy (Engleska). Ime mu potječe od grčkog naziva za magnezijev oksid (MgO) - magnesia alba, prema okrugu u Thessaly, Grčka. To je polutvrdi, sjajni, srebrno bijeli metal, koji na zraku potamni zbog zaštitne prevlake oksida. Može se kovati, lijevati i valjati. Gori na zraku uz pojavu vrlo intenzivne svjetlosti. Lako se otapa u kiselinama a reagira i s vodom na povišenim temperaturama uz oslobađanje vodika. Magnezij se upotrebljava kao snažno redukcijsko sredstvo koje može reducirati mnoge metalne okside. Najvažniji izvor magnezija su minerali dolomit (CaCO3·MgCO3) i magnezit (MgCO3), te morska voda. Glavno područje primjene magnezija je metalurgija, posebno za izradu lakih legura.
živa → mercury
Živa je poznata od davnih vremena (~1500. godine prije Krista). Ime je dobila od latinske riječi hydrargyrum što znači tekuće srebro. To je sjajni, srebrno bijeli metal. Pri sobnoj temperaturi je tekućina. Loše vodi toplinu i električnu struju. Stabilna je na zraku. Ne reagira s lužinama i većinom kiselina. Otapa se samo u oksidirajućim kiselinama. Tekuća živa otapa mnoge metale dajući amalgame. Ovisno o količini otopljenog metala, amalgami mogu biti tekući ili čvrsti. Živine pare su vrlo otrovne. Lako se resorbira čak i preko nepokrivenih dijelova kože. Imaju kronični kumulativni efekt. Organski spojevi žive, kao što je metil-živa, su također jaki otrovi. U prirodi žive ima dvadesetak puta više nego kadmija. Može se pronaći samorodna ili u mineralu cinabaritu (HgS). Klor-alkalne elektrolize su najveći potrošači žive gdje se živa upotrebljava kao katoda kod elektrolize, zbog velikog prenapona vodika na njoj i stvaranja amalgama s produktom. Sa živom se pune termometri, barometri ili se izrađuju lampe koje isijavaju svjetlost bogatu ultraljubičastim zrakama.
metal → metal
Metali ili kovine čine više od dvije trećine svih elemenata koji se mogu naći u prirodi. Od 114 poznatih elemenata, samo 17 su nemetali, 7 su polumetali a ostalih 89 mogu se svrstati u metale.
Metali su neprozirni, imaju karakterističan metalni sjaj, dobri su vodiči topline i električne struje. Električna vodljivost metala općenito opada porastom temperature.
Većina se metala može dobro kovati i istezati. Na sobnoj su temperaturi svi, osim žive, u čvrstom stanju. Mogu se koristiti u čistom stanju, ali se češće miješaju s drugim metalima i nemetalima u legure.
metalno staklo → metallic glass
Određene slitine mogu se, metodom ultrabrzog kaljenja iz taline, skrutnuti u amorfnom obliku, bez formiranja kristalne rešetke - takve, amorfne slitine zovu se metalna stakla.
Primjer su dobivanja metanih stakala cirkonija i nikla. Amorfna Zr2Ni slitina dobiva se metodom ultrabrzog hlađenja, kod koje se indukcijski rastaljena slitina izbacuje tlakom inertnog plina iz kvarcne posude na plohu brzo rotirajućeg valjka. Valjak je napravljen od materijala velike toplinske vodljivosti i na njemu se slitina, zbog velike brzine kojom je izbačena, spreša, naglo ohladi i skrutne. Nakon skrućivanja slitina se od valjka odvaja zbog djelovanja centrifugalne sile. Tako se dobivaju dugačke trake amorfne slitine jednolike širine (~1 mm) i debljine (~1 μm) te poprečnog presjeka kojemu svojstva ovise o brzini hlađenja.
Strukturno svojstvo metalnih stakala jest odsustvo uređenja dugog dosega. Na udaljenostima manjim od 1.5 nm postoje određeni tipovi uređenosti pa ta činjenica ne dozvoljava potpunu usporedbu sa strukturom tekućina, kojoj je svojstvena potpuna neuređenost. Struktura metalnih stakala određuje njihova neobična fizikalna svojstva, sasvim različita od svojstava odgovarajućih kristalnih slitina, a vrlo povoljna za primjene u tehnologiji. Mehaničke osobine (čvrstoća, elastičnost, otpornost na koroziju) čine neka stakla pogodnim za izradu kompozitnih materijala. Slitine prijelaznih metala i rijetkih zemalja mogu imati svojstva između mekih i vrlo tvrdih magneta pa se mogu upotrijebiti kao magnetske memorije. Supravodljivi amorfni metali mogu se koristiti za izradu rotora supravodljivih generatora i motora.
Mohsova skala → Moh’s scale
Mohsova skala tvrdoće minerala je skala po kojoj se određuje i izražava tvrdoća pojedinih minerala. Napravio ju je njemački mineralolog Friedrich Mohs (1773.-1839.) i karakterizira je otpornost na grebanje tvrđim mineralom. Mohs je svoju ljestvicu temeljio na deset lako dostupnih minerala.
| Tvrdoća | Mineral |
|---|---|
| 1 | talk (Mg3Si4O10(OH)2) |
| 2 | gips (CaSO4·2H2O) |
| 3 | kalcit (CaCO3) |
| 4 | fluorit (CaF2) |
| 5 | apatit (Ca5(PO4)3(OH-,Cl-,F-)) |
| 6 | ortoklas feldšpar (KAlSi3O8) |
| 7 | kvarc (SiO2) |
| 8 | topaz (Al2SiO4(OH-,F-)2) |
| 9 | korund (Al2O2) |
| 10 | dijamant (C) |
molibden → molybdenum
Molibden je 1778. godine otkrio Carl William Scheele (Švedska). Ime je dobio od grčke riječi molibdos što znači olovo. To je sjajni, srebrni, vrlo tvrdi metal ali mekši od wolframa. Može se dobiti i u obliku tamno sivog do crnog praha. Otporan je na otopine i taline lužina, a ne otapa se ni u hladnim kiselinama koje nemaju oksidacijsko djelovanje. U Zemljinoj kori ima ga otprilike sto puta manja od kroma. Glavne rude molibdena su molibdenit (MoS2), powelit (CaMoO4) i vulfenit (PbMoO4). Mnogo molibdena se dobiva kao nusproizvod kod dobivanja bakra. Najviše se primjenjuje u metalurgiji za legiranje čelika koji se upotrebljavaju za izradu brzoreznih alata. Već i mali postotak molibdena daje čeliku veliku tvrdoću koja se zadržava i pri visokim temperaturama.
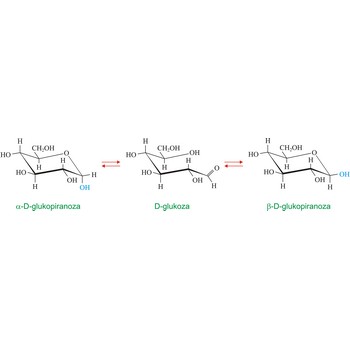
mutarotacija → mutarotation
Mutarotacija je promjena optičke aktivnosti uzrokovana epimerizacijom. U kemiji ugljikohidrata ovaj termin obično se odnosi na epimerizaciju anomernog ugljikovog atoma. U vodenoj otopini postiže se ravnotežna smjesa dvaju anomera koji prelaze jedan u drugi preko otvorenog aldehidnog oblika. Otapanjem čiste α-D-glukopiranoze ([α]D = +112.2°) ili čiste β-D-glukopiranoze ([α]D = +18.7°)u vodi dolazi do promjene zakretanja svjetlosti koje na kraju uvijek iznosi [α]D = +52.6deg;. U ravnoteži se nalazi 36 % α- i 64 % β-oblika dok je aldehidni oblik prisutan u jako niskoj koncentraciji. Mutarotaciju je 1846. otkrio francuski kemičar Augustin-Pierre Dubrunfaut (1797.-1881.).Citiranje ove stranice:
Generalić, Eni. "Tvrdoća vode." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav