dijamant → diamond
Dijamant (alem-kamen) jest jedan od kristaliziranih oblika elementa ugljika. Najtvrđi je mineral, jake refleksije, većinom bezbojan i proziran. Od primjesa može biti modar, crven, smeđ, žut, zelen i crn. Dijamant nastaje kristalizacijom magme u velikim dubinama. U primarnim ležištima nalazi se u bazičnim eruptivnim stijenama; njihovim trošenjem mogu dijamanti biti isprani i odneseni u pijesak u sekundarna ležišta.
dijastereoizomer → diastereoisomer
Dijastereoizomeri (dijastereomeri) jesu stereoizomeri spojeva s dva ili više kiralnih centara koji se ne odnose kao predmet i njegova zrcalna slika. Primjerice, u strukturi na slici 1 i 2 su enantiomeri kao i 3 i 4; 1 i 3, 2 i 4 kao i 1 i 4 su dijastereoizomeri. Za razliku od enantiomera, dijastereoizomeri obično nemaju slična fizikalna i kemijska svojstva.
diferencijalna termalna analiza → differential thermal analysis
Diferencijalna termalna analiza (DTA) postupak je koji se često koristi pri analizi materijala koji reagira ili se raspada na višim temperaturama. Prati se razlika u temperaturi između uzorka i inertnog referentnog materijala. Fazne promjene i kemijske reakcije što se odvijaju u uzorku s povećanjem temperature povećavaju temperaturnu razliku na temperaturama koje su karakteristične za uzorak.
difrakcija → diffraction
Difrakcija ili rasipanje osobina je valova da se svijaju na rubovima zapreka ili rupa. Efekt je to izraženiji što je prepreka ili rupa po veličini usporediva s valnom duljinom.
difuzija → diffusion
Difuzija je spontano miješanje dviju ili više tvari kroz njihovu dodirnu površinu ili propusnu membranu. Čestice (atomi, molekule, ioni itd.) putuju iz područja više u područje niže koncentracije. Difuzija se najbrže odvija u plinovima, sporije u tekućinama a najsporije u čvrstim tijelima. Difuzija je jedan od mehanizama (uz konvekciju i migraciju) odgovoran za transport mase u otopini. Teoretska osnova difuzije dana je Fickovim zakonom.
dioksin → dioxin
Dioksini su organski spojevi koji pripadaju u grupu polikloriranih ugljikovodika, točnije polikloriranih bifenila. Najopasniji od njih je TCDD (2,3,7,8-tetraklorodibenzo-p-dioksin) ili jednostavno dioksin. Dioksin nastaje izgaranjem mnoštva organskih tvari, često i organskih otpadaka prilikom spaljivanja otpada, a i kao nusprodukt u raznim kemijskim procesima u organskoj kemijskoj industriji. U tragovima ga je bilo u poznatoj kemikaliji Agent Orange koja se upotrebljavala u Vijetnamskom ratu za defolijaciju šuma. Također je poznat iz incidenta u Tvornici kemijskih proizvoda u Sevesu u Italiji gdje je dioksin onečistio okolinu.
Dioksini su kemijski stabilni, netopljivi u vodi, ali vrlo lako topljivi u mastima i uljima. Istraživanja potaknuta tvrdnjama da je herbicid štetio vijetnamskim veteranima i radnicima u kemijskoj industriji potvrdila su visoku toksičnost, teratogenost, kancerogenost i mutagenost dioksina. U posljednje vrijeme objavljeni su i radovi u kojima se upozorava da se i neki spojevi iz ispušnih plinova automobila ponašaju slično dioksinu.
Strukturna formula izgleda ovako:
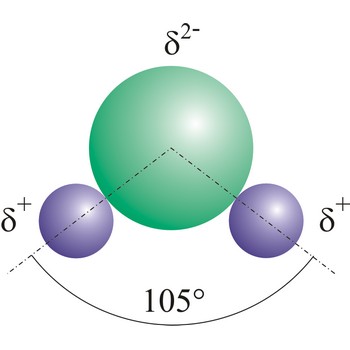
dipolna molekula → dipole molecule
Dipolne molekule nastaju kad zajednički elektronski par kod kovalentne veze nije simetričan. Ukoliko se kovalentnom vezom vežu raznovrsni atomi, koji mogu imati različit afinitet za elektrone, onda atom s većim afinitetom jače privuče elektronski par. Time dolazi do asimetrične raspodjele negativnog naboja u molekuli, čime jedan dio molekule postaje relativno negativno nabijen (kome je bliže elektronski par) a drugi relativno pozitivno nabijen.
disaharid → disaccharide
Disaharidi su šećeri sastavljeni od dviju molekula monosaharida spojenih glikozidnom vezom. Glikozidna veza na anomerni ugljikov atom može biti α ili β. Primjerice, maltoza, disaharid dobiven enzimskom hidrolizom škroba, sastoji se od dvije molekule D-glukopiranoze povezane 1,4’-α-glikozidnom vezom. Apostrof nam kazuje da se C-4 i C-1 atomi ne nalaze u istom šećernom prstenu. Za razliku od ostalih disaharida, monosaharidi u saharozi, α-D-glukopiranoza i β-D-fruktofuranoza, povezani su glikozidnom vezom preko svojih anomernih ugljikovih atoma. Zbog toga je saharoza nereducirajući šećer i ne dolazi do mutarotacije.
disocijacija → dissociation
Disocijacija je proces pri kojem se kemijska vrsta (molekula, ion i sl.) rastavlja na jednostavnije dijelove kao rezultat dodane energije (toplinska disocijacija) ili zbog djelovanja otapala (elektrolitička disocijacija). Disocijacija se može odvijati u plinovitoj, tekućoj ili krutoj fazi, ili se može dešavati u otopini. Primjer disocijacije je reverzibilna reakcija HI na visokoj temperaturi
Izraz disocijacija upotrebljava se i za reakcije ionizacije kiselina i baza u vodi. Primjerice, reakcija cijanovodične kiseline
često se piše kao disocijacija kiseline na ione
konstanta disocijacije → dissociation constant
Konstanta disocijacije je konstanta čija brojčana vrijednost daje odnos ravnotežnih koncentracija nedisociranog i disociranog oblika molekule. Što je konstanta disocijacije veća, to je više molekula disociralo.
Izraz disocijacija upotrebljava se i za reakcije ionizacije kiselina i baza u vodi. Primjerice, reakcija
često se piše kao disocijacija kiseline na ione
Konstanta ravnoteže za ovakvu reakciju naziva se konstanta disocijacije kiseline (Ka).
Koncentracija vode [H2O] toliko je velika da se može smatrati konstantnom.
Slično tome, može se i ionizacija baze u vodi napisati kao
Konstanta disocijacije baze dana je s
Ka (Kb) je mjera za jakost kiseline (baze).
Citiranje ove stranice:
Generalić, Eni. "S visc chemistry." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav