kemijska ravnoteža → chemical balance
Kemijska ravnoteža je stupanj reverzibilne reakcije u zatvorenom sustavu kad se napredna i povratna reakcija događaju istom brzinom, a njihovi se učinci međusobno poništavaju, dok se koncentracije reaktanata i produkata ne mijenjaju.
kemijska jednadžba → chemical equation
Kemijska jednadžba je način prikazivanja kemijske reakcije upotrebom simbola za reagirajuće čestice (atome, molekule, ione itd.). Na lijevoj strani jednadžbe pišemo formule ili simbole čestica koje stupaju u kemijsku reakciju, reaktante. Na desnoj strani jednadžbe pišemo formule ili simbole čestica koje nastaju kemijskom reakcijom, produkte.
Kod reverzibilnih reakcija umjesto znaka jednakosti stavlja se dvostruka strelica a kod ireverzibilnih jednostruka. Ako reakcija sadrži više faza, uobičajeno je staviti oznaku faze u zagrade neposredno iz formule:
| s | = | čvrsto (solid) |
| l | = | tekuće (liquid) |
| g | = | plinovito (gas) |
| aq | = | vodena otopina (aqueous) |
Brojevi a, b, c i d pokazuju relativni broj molekula koje sudjeluju u reakciji i nazivaju se stehiometrijski koeficijenti. Dogovoreno je da je stehiometrijski koeficijent pozitivan za reaktante a negativan za produkte. Ako je suma stehiometrijskih koeficijenata jednaka nuli, reakcija je uravnotežena.
Da bi se napisala jednadžba kemijske reakcije, moraju biti poznati svi reaktanti i produkti kemijske reakcije kao i njihovi stehiometrijski odnosi. Poznavanje jednadžbe kemijske reakcije omogućuje nam da odredimo količine međusobno ekvivalentnih tvari.
disocijacija → dissociation
Disocijacija je proces pri kojem se kemijska vrsta (molekula, ion i sl.) rastavlja na jednostavnije dijelove kao rezultat dodane energije (toplinska disocijacija) ili zbog djelovanja otapala (elektrolitička disocijacija). Disocijacija se može odvijati u plinovitoj, tekućoj ili krutoj fazi, ili se može dešavati u otopini. Primjer disocijacije je reverzibilna reakcija HI na visokoj temperaturi
Izraz disocijacija upotrebljava se i za reakcije ionizacije kiselina i baza u vodi. Primjerice, reakcija cijanovodične kiseline
često se piše kao disocijacija kiseline na ione
konstanta ravnoteže → equilibrium constant
Konstanta ravnoteže (K) prvi put se pojavljuje u zakonu o djelovanju masa koji su 1863. formulirali norveški kemičari C.M. Guldberg i P. Waage. Reverzibilna kemijska reakcija prikazana jednadžbom
u ravnoteži je onda kada je brzina napredne reakcije jednaka brzini povratne reakcije.
Konstanta ravnoteže definirana je odnosom ravnotežnih aktiviteta produkata i reaktanata
Kod praktičnih mjerenja često se aktiviteti zamjenjuju koncentracijama
Za reakcije u plinskoj fazi umjesto koncetracija upotrebljavaju se parcijalni tlakovi
Termodinamička konstanta K nema jedinicu, dok jedinica za Kp i Kc ovisi o broju molekula koje se pojavljuju u stehiometrijskoj jednadžbi (a, b, c i d).
Veličina konstante ravnoteže ovisi o temperaturi. Ako je napredna reakcija egzotermna, konstanta ravnoteže smanjuje se povećanjem temperature. Što je veća konstanta ravnoteže neke kemijske reakcije, to je ravnoteža više pomaknuta na stranu stvaranja produkata reakcije. Položaj uspostavljene ravnoteže može se mijenjati, ali ne i konstanta. Sustav u ravnoteži brani se od promjene tako da nastoji poništiti vanjski utjecaj (Le Chatelierov princip).
Konstanta ravnoteže kemijske reakcije izravno je proporcionalna promjeni standardne Gibbsove slobodne energije
povrativi članak → reversible cell
Povrativi članak je elektrokemijski članak kod kojeg su kemijske reakcija na elektrodama reverzibilne. Akumulatori su primjer povrativog članka.
Gibbsova slobodna energija → Gibbs free energy
Gibbsova slobodna energija (G) jest energija oslobođena ili apsorbirana u reverzibilnom procesu pri konstantnoj temperaturi i tlaku. Definirana je jednadžbom
gdje je H entalpija, S entropija a T termodinamička temperatura. Naziva se još i Gibbsova energija ili samo slobodna energija.
Promjena Gibbsove slobodne energije, ΔG, određuje smjer kemijske reakcije. Ako je ΔG neke reakcije negativan, reakcija će se spontano odvijati dok se ne uspostavi ravnotežno stanje. Kada je postignuto ravnotežno stanje, onda je ΔG = 0.
Haberov proces → Haber process
Haberov proces je industrijski postupak sinteze amonijaka iz dušika i vodika:
Reakcija je egzotermna i reverzibilna, tako da se prinos na amonijaku povećava na nižim temperaturama. Brzina reakcije je previše mala na normalnoj temperaturi, pa se reakcija provodi pri optimalnoj temperatura od oko 450 °C. U reakciji se kao katalizator koristi željezo s aluminijevim oksidom kao promotorom. Povišenjem tlaka reakcija se pomiče u smjeru nastajanja amonijaka, pa se koristi tlak od 250 atmosfera. Amonijak se uklanja iz reaktora čime se reakcija pomiče u smjeru nastajanja produkata. Kao izvor vodika u originalnom procesu koristio se vodeni plin, dok se danas koristi vodik dobiven reformiranjem zemnog plina.
Proces je vrlo važan jer je to jedini industrijski način fiksacije dušika iz zraka u svrhu dobivanja umjetnih gnojiva i eksploziva. Postupak je razvio 1908. njemački kemičar Fritza Haber (1868.-1934.), a za industrijsku primjenu prilagodio ga je Carl Bosh (1874.-1940.), te se postupak još naziva Haber-Boshov postupak.
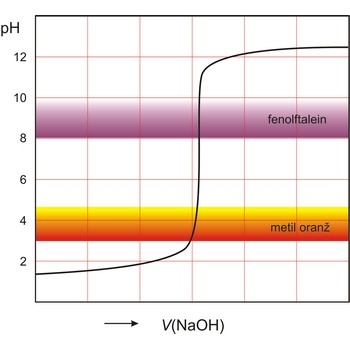
indikator → indicator
Indikator je tvar koja u otopini daje vidljivu promjenu (obično promjenu boje) u prisutnosti kemijske vrste. Koriste se za označavanje završetka kemijske reakcije. Indikatori se dijele prema vrstama kemijskih reakcija u kojima se primjenjuju (kiselo-lužnate, redoks, taložne, kompleksirajuće i adsorpcijske).
Kiselo-bazni indikatori su spojevi, kao npr. fenolftalein i metil oranž, koji reverzibilno mijenjaju boju ovisno o tome je li otopina kisela ili bazna. Oksidacijsko-redukcijski indikatori su tvari koje reverzibilno mijenjaju boju između svog oksidiranog i reduciranog oblika.
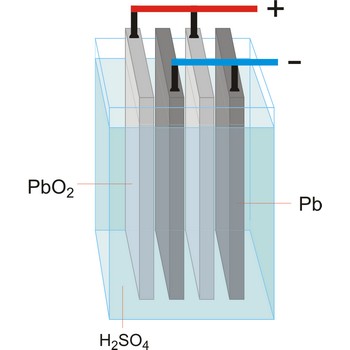
olovni akumulator → lead-acid battery
Olovni akumulator je naprava koja koristi reverzibilne kemijske reakcije za spremanje električne energije. Godine 1859. francuski fizičar Gaston Planté osmislio je prvi olovni akumulator koji se sastojao od olovnih ploča uronjenih u razrijeđenu sumpornu kiselinu. Olovo uronjeno u sulfatnu kiselinu presvuče se slojem olovo(II) sulfata. Ako se kroz ovaj sustav propušta istosmjerna struja dolazi na elektrodama do slijedećih reakcija:
Tako je dobiven izvor struje napona 2 V, koji je poznat kao olovni akumulator. Sam proces pretvaranja električne energije u kemijsku naziva se punjenje akumulatora.
Spajanjem polova olovnog akumulatora u strujni krug na elektrodama se dešavaju slijedeće reakcije:
Proces kojim se kemijska energija pretvara u električnu naziva se pražnjenjem akumulatora.
Olovni akumulatori imaju nisku cijenu, relativno velik napon po ćeliji, malen unutrašnji otpor i mogu dati velike jakosti struje u kratkom vremenu. Mane su mu otrovnost olova, velika masa i pojava samopražnjenja.
reverzibilan proces → reversible process
Reverzibilan proces ili reakcija takav je proces koji se može odvijati u obrnutom smjeru pomoću infinitezimalno male promjene u uvjetima. Npr. voda i led postoje zajedno pri temperaturi od 0 °C i tlaku od 101 325 Pa. Malo povišenje temperature uzrokuje topljenje leda, isto tako malo smanjenje temperature uzrokuje zamrzavanje vode. Otapanje ili zamrzavanje pri ovim uvjetima može se smatrati reverzibilnim.
Citiranje ove stranice:
Generalić, Eni. "Reverzibilna reakcija." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav