anionski izmjenjivač → anion exchange
Anionski izmjenjivači zamjenjuju anione iz otopine s OH- ionima. U svojoj strukturi imaju grupe bazičnog karaktera (-NH2, -NRH, -NR2, -NR3+).
vodena otopina → aqueous solution
Vodene otopine one su otopine kod kojih kao otapalo služi voda. Vodena se otopina u jednadžbi kemijske reakcije označava kao (aq).
konstanta disocijacije kiseline → acid dissociation constant
Konstanta disocijacije kiseline (Ka) ravnotežna je konstanta za disocijaciju kiseline HA prema reakciji
U praksi se često koristi oznaka p za negativni logaritam konstante disocijacije.
energija aktivacije → activation energy
Energija aktivacije ili energija aktiviranja reakcije (Ea) energija je koju je potrebno dovesti molekulama da međusobno reagiraju. Da bi molekule kemijski reagirale, moraju se sudariti, ali međusobno mogu reagirati samo one molekule koje imaju veću energiju od energije aktiviranja. U kemijskoj kinetici energija aktivacije je visina potencijalne barijere koja odvaja produkte od reaktanata. Što je energija aktivacije veća, to manji broj molekula može prijeći vrh energetske barijere i reakcija je sporija.
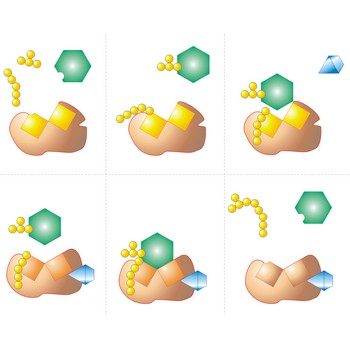
aktivno mjesto → active site
Aktivno mjesto je džep, odnosno udubina na enzimskoj molekuli koja odgovara molekuli reaktanta kao ruka rukavici. Aktivno mjesto smanjuje energiju aktivacije dotične reakcije.
aktivitet → activity
Aktivitet (a) je djelotvorna koncentracija neke tvari u otopinama elektrolita. U idealnoj otopini na čestice otopljene tvari djeluju samo molekule otapala, dok kod realnih otopina privlačne sile između iona u otopini rastu s povećanjem naboja iona i povećanjem njihove koncentracije, čime se smanjuje efektivna koncentracija iona u otopini. Aktivitet je jednak umnošku koeficijenta aktiviteta (f) i koncentracije (c)
Relativni aktivitet govori nam koliko je puta neka otopina aktivnija od istovrsne referentne otopine. Za standardno referentno stanje uzima se otopina tvari pri beskonačnom razrjeđenju kada je koeficijent aktiviteta jednak jedinici.
Aktivitet i koeficijent aktiviteta bezdimenzijske su veličine. Aktivitet je jednak koncentraciji tek u vrlo razrijeđenim otopinama. Za čvrste tvari uzima se da je aktivitet jednak jedinici.
azo-spojevi → azo compounds
Azo-spojevi organski su spojevi kod kojih su dvije skupine povezane -N=N- skupinom. Mogu nastati reakcijom diazonijeva iona s benzenskim prstenom.
Boudouardova ravnoteža → Boudouard’s equilibrium
Ravnoteža koja se uspostavlja kod reakcije ugljikova(IV) oksida s ugljikom naziva se Boudouardova ravnoteža. Zbog endotermnosti reakcije povećanje temperature pomiče reakciju udesno a sniženje temperature ulijevo.
Bronstedova kiselina → Bronsted acid
Brønstedova kiselina je tvar koja u kemijskoj reakciji daje proton.
Citiranje ove stranice:
Generalić, Eni. "Reverse reaction." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav