teorija valentne veze → valence bond theory
Teorija valentne veze jest teorija koja objašnjava oblik molekule pomoću preklapanja polupopunjenih atomskih orbitala ili polupopunjenih hibridiziranih orbitala.
asparagin → asparagine
Asparagin je neutralna aminokiselina s polarnim pobočnim lancem. Jako često se nalazi u aktivnim centrima bjelančevina gdje služi kao mjesto za vezivanje ugljikovodika i glikoproteina. Asparagin je amidni derivat asparaginske kiseline i generalno gledajući nije previše reaktivan. To nije esencijalna kiselina jer se može sintetizirati kroz ljudski metabolizam i ne mora se posebno unositi hranom.
- Kratice: Asn, N
- IUPAC ime: 2,4-diamino-4-oksobutanska acid
- Molekularna formula: C4H8N2O3
- Molekularna masa: 132.12 g/mol
radijus atoma → atom radius
Atomi i molekule nemaju oštrih granica. Kao volumen slobodnog atoma obično se definira onaj volumen koji sadrži 90 % elektronskog oblaka. Radijus atoma predstavlja polovicu međuatomske udaljenosti dvaju istovrsnih atoma, koji su u dodiru, ali nisu međusobno povezani ni kovalentnom ni ionskom vezom, već vrlo slabom van der Waalsovom vezom.
Lewis, Gilbert N. → Lewis, Gilbert N.
Gilbert Newton Lewis (1875.-1946.) američki je kemičar koji je teorijom elektronskih parova objasnio kovalentne veze i proširio pojam kiselina i baza.
umrežavanje → cross-linking
Umrežavanje je povezivanje dvaju lanaca polimerne molekule preko elemenata ili skupina vezanih kovalentnom vezom na lanac makromolekule.
U prirodi se često umrežavaju polipeptidni lanci disulfidnim mostovima preko cisteinskih ostataka, kao u keratinu ili inzulinu. Polimeri se mogu umrežiti dodatkom kemijske tvari ili izlaganjem polimera visokoenergetskom zračenju. Primjerice: vulkanizacija gume sa sumporom, umrežavanje poistirena s divinilbenzenom ili umrežavanje polietilena zračenjem.
Umrežavanjem se smanjuje plastičnost polimera, pojačava jakost, toplinska i električna otpornost kao i otpornost na različita otapala.
organometalni spoj → organometallic compound
Organometalni spojevi su spojevi u kojima postoji kovalentna veza između atoma ugljika i atoma metala (C-Me).
Paulingova skala → Pauling scale
Paulingova skala je numerička skala elektronegativnosti temeljena na računanju energije veze kovalentno vezanih elemenata. Elektronegativnost je sila kojom atom privlači zajednički elektronski par. Fluorid je najelektronegativniji element i ima vrijednost 4 na Paulingovoj skali.
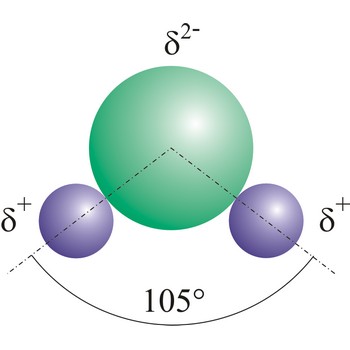
dipolna molekula → dipole molecule
Dipolne molekule nastaju kad zajednički elektronski par kod kovalentne veze nije simetričan. Ukoliko se kovalentnom vezom vežu raznovrsni atomi, koji mogu imati različit afinitet za elektrone, onda atom s većim afinitetom jače privuče elektronski par. Time dolazi do asimetrične raspodjele negativnog naboja u molekuli, čime jedan dio molekule postaje relativno negativno nabijen (kome je bliže elektronski par) a drugi relativno pozitivno nabijen.
Citiranje ove stranice:
Generalić, Eni. "Polarna kovalentna veza." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav