jednadžba stanja idealnog plina → ideal gas law
Jednadžba stanja idealnog plina izvedena je kombinacijom Boyle-Mariotteova, Charles-Gay-Lussacova i Avogadrova zakona. Stanje idealnog plina određeno je tlakom, volumenom, množinom i temperaturom. Njihova međusobna ovisnost dana je jednadžbom
gdje je p tlak, V molarni volumen, T temperatura a R opća plinska konstanta s vrijednošću 8.314 JK-1mol-1).
alotrop → allotrope
Alotropi su elementi koji se mogu javiti u dva ili više modifikacija u istom agregatnom stanju. Alotropi obično imaju različita fizikalna svojstva a često su im i kemijska svojstva različita.
Dijamant, grafit i fuleren su tri alotropske modifikacije elementa ugljika. Grafit je mekana, crna tvar koja vodi struju a dijamant je najtvrđa poznata tvar, proziran je i izolator. Ta dva alotropa ugljika razlikuju se jedan od drugoga po kristalnom obliku. Dijamant kristalizira u teseralnom a grafit u heksagonskom sustavu. Ugljikovi atomi u fulerenskoj molekuli raspoređeni su unutar peterokuta i šesterokuta i čine šuplju kuglu koja se sastoji od 60 i više ugljikovih atoma.
U nekim slučajevima alotropi su stabilni samo u određenom temperaturnom području koje je definirano temperaturom pretvorbe pri kojoj jedan alotrop prelazi u drugi. Primjerice, bijeli (metalni) kositar stabilan je ispod 13.2 °C a sivi (nemetalni) kositar stabilan je iznad 13.2 °C.
Izraz alotrop koristi se i za različite molekularne oblike nekog elementa. Elementarni kisik ima dvije alotropske modifikacije: obični kisik i kemijski aktivniji troatomni kisik - ozon.
alotropija → allotropy
Alotropija (gr. allos, drugačije, and tropos, ponašanje) je pojavljivanje elemenata u dva ili više različitih molekulskih ili kristalnih oblika koji imaju različita kemijska i fizikalna svojstva. Razlika između ovih oblika može biti u njihovoj kristalnoj strukturi (bijeli, crveni i crni fosfor), broju atoma u molekuli (dvoatomni kisik i troatomni ozon) ili u molekularnoj strukturi kapljevine (tekući helij i helij II).
U nekim slučajevima alotropi su stabilni samo u određenom temperaturnom području koje je definirano temperaturom pretvorbe pri kojoj jedan alotrop prelazi u drugi. Primjerice, bijeli (metalni) kositar stabilan je ispod 13.2 °C a sivi (nemetalni) kositar stabilan je iznad 13.2 °C. Ova vrsta alotropije naziva se enantiotropija. Alotropija kod koje nema temperature (točke) pretvorbe naziva se monotropija.
Izraz alotropija ne može se primijeniti na tvari u različitim agregatnim stanjima, npr. kada se led topi i prelazi iz čvrstog leda u tekuću vodu.
Alotropija općenito opisuje pojavu polimorfizma kod elemenata, dok se polimorfija odnosi na svaku tvar koja može imati više kristalnih struktura.
ledište → freezing point
Ledište je temperatura pri kojoj tekućina prelazi u čvrsto agregatno stanje pri normalnom tlaku.
Vidi Talište
toplina taljenja → heat of fusion
Toplina taljenja ili entalpija taljenja jest količina topline potrebna da se jedan mol čvrste tvari na temperaturi tališta prevede potpuno u tekuće agregatno stanje.
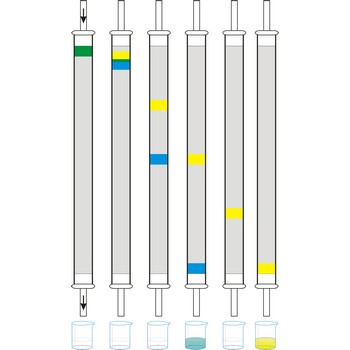
kromatografija u koloni → column chromatography
Kromatografija u koloni (na stupcu) je metoda kod koje se mobila faza kreće kroz usku cijev, pod utjecajem tlaka ili gravitacije, ispunjenu stacinarnom fazom. Kolonska kromatografija najčešće se koristi za separaciju uzorka, kako bi se izdvojila željena komponenta iz smjese. Ovisno o agregatnom stanju mobilne faze imamo plinsku (GC, gas chromatography) i tekućinsku kromatografiju (LC, liquid chromatography).
kriogena frakcinacija → cryogenic fractionation
Kriogena frakcinacija proces je odvajanja plinova na način da ih se ohladi dok ne prijeđu u tekuće stanje. Ovom se metodom koriste velike kompanije pri proizvodnji tekućih plinova kao što su tekući kisik, tekući dušik itd. Plinovi imaju različitu točku vrenja (temperatura pri kojoj prelaze iz tekućeg stanja u plinovito): kisik vrije pri -183 °C, a dušik pri -195.8 °C. Znači ako zrak ohladimo, na-183 °C odvojiti će se kisik kao tekućina a dušik će ostati u plinovitoj fazi.
toplina isparavanja → heat of vaporisation
Toplina isparavanja ili entalpija isparavanja jest toplina potrebna da se tekućina prevede u plinovito stanje na temperaturi vrelišta. Izrazimo li je po jedinici mase, dobivamo specifičnu toplinu isparavanja, a ako ju izrazimo po jedinici množine tvari, dobivamo molarnu toplinu isparavanja.
heterogena reakcija → heterogenic reaction
Heterogene reakcije one su reakcije koje se zbivaju u različitim fazama (u različitim agregatnim stanjima).
Citiranje ove stranice:
Generalić, Eni. "Plinovito agregatno stanje." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav