klorinitet → chlorinity
Klorinitet (simbol Cl) je definiran kao ukupna količina halida (klorida, bromida i jodida) u 1 kg mora, a da su pri tome jodid i bromid zamijenjeni ekvivalentnom količinom klorida. Kako bi se napravio neovisnim o promjenama atomskih masa halida, klorinitet se danas definira kao masa čistog srebra potrebna da se istalože svi kloridi, bromidi i jodidi pomnožena s 0.37285233. Klorinitet se općenito određuje kako bi se izračunala slanost (salinitet) mora.
Klorinitet se određuje Mohrovom metodom, jednom od najstarijih metoda titracije - uveo ju je 1856. njemački kemičar Karl Friedrich Mohr (1806.-1879.), titracijom uzorka mora sa standardnom otopinom srebrovog nitrata (AgNO3) uz kalijev kromat (K2CrO4) kao indikator.
pri tome se uz AgCl talože još i AgBr i AgI.
Problem kod Mhorove titracije je u tome što srebrov nitrat nije primarni standard. Kako bi ovo izbjegao i omogućio da sva mjerenja saliniteta budu usporediva, predsjednik Međunarodnog povjerenstva za istraživanje mora (ICES, International Council for the Exploration of the Sea), danski fizičar Martin Knudsen (1871.-1949.) definirao je kao standard Normalnu vodu (Eau de mer Normale) stalnog sastava s točno određenim klorinitetom (oko 19.38 ‰). Ova voda je potom korištena za standardizaciju otopine srebrova nitrata. Na taj način sva određivanja kloriniteta referirala su se na isti standard što je omogućilo da svi rezultati budu usporedivi. Upotrebom Normalne vode, Knudsenove pipete i birete za analizu te Hidrografskih tablica dobivali su se rezultati točnosti usporedive onima dobivenim gravimetrijom.
Mjerenjem saliniteta i kloriniteta u devet uzoraka mora iz različitih dijelova svijeta Knudsen je, 1889., došao do empirijske formule za određivanje saliniteta:
Ova formula koristila se do 1962., kada je Zajedničko vijeće za oceanografske tablice i standarde (JPOTS, Joint Panel for Oceanographic Tables and Standards) odredilo novu konstantu proporcionalnosti u Knudsenovoj formuli
teorija sudara → collision theory
Teorija sudara je teorija koja objašnjava kako se događaju kemijske reakcije i zašto se mijenja brzina reakcije. Da bi se reakcija dogodila moraju se molekule reaktanta sudariti. Samo dio sudara, uspješni sudari, uzrokuje kemijske promjene. Uspješni sudari imaju dovoljno energije (aktivacija energija) u trenutku sudara da prekinu postojeće veze i stvore nove veze, stvarajući reakcijske produkte. Povećavanje koncentracije reaktanata i povišenje temperature povećava broj sudara, odnosno dovodi do povećanja brzine reakcije.
izotopni omjer → isotope proportion
Izotopni omjer je omjer broja atoma svakog izotopa u uzorku jednog elementa. Koristi se relativnim masama izotopa za izračunavanje relativne mase atoma jednog elementa.
litra → litre
Litra (l, L) je iznimno dopuštena jedinica volumena (obujma), definirana je kao poseban naziv za kubični decimetar (L = dm3). Njezini su uobičajeni nižekratnici centilitra (cl, cL) i mililitra (ml, mL). Oznaku velikog slova za litru prihvatio je CGPM 1979 kako bi se izbjegao rizik zamjene l s brojem 1.
kompleksometrija → complexometry
Kompleksometrija je volumetrijska analitička metoda koja se temelji na titraciji otopina metalnih iona pomoću tvari koja s njima tvori kompleksne spojeve, npr. EDTA. Kod kompleksometrijskog određivanja s EDTA , reakcija iona metala, bez obzira na njihov oksidacijski broj, je u stehiometrijskom odnosu 1:1.
bakar → copper
Bakar je poznat od davnih vremena (~5000. godine prije Krista). Ime mu dolazi od latinske riječi za otok Cipar - Cyprium. To je svijetlo crvenkasti, sjajni metal. Relativno je mekan, ali žilav i savitljiv. Dobro vodi toplinu i električnu struju. Na zraku je stabilan, ali dužim stajanjem dobije zelenu patinu. Otapa se samo u oksidirajućim kiselinama. U prisutnosti kisika iz zraka otopit će se i u razrijeđenoj sulfatnoj kiselini i koncentriranoj kloridnoj kiselini. Bakar se u prirodi nalazi i elementaran, ali se pretežno javlja kao halkopirit (Cu2S·Fe2S3), halkozin (Cu2S), kovelin (CuS), kuprit (Cu2O), malahit (CuCO3·Cu(OH)2), azurit (2CuCO3·Cu(OH)2) i bornit (Cu5FeS4). Oko pola proizvodnje bakra upotrebljava se za izradu vodiča električne struje. Zbog dobre toplinske vodljivosti od njega se izrađuju kotlovi, grijači i razni izmjenjivači topline. Važno područje primjene bakra je dobivanje legura, u prvom redu mjedi ili mesinga (Cu-Zn-legura) i bronce (Cu-Sn-legura).
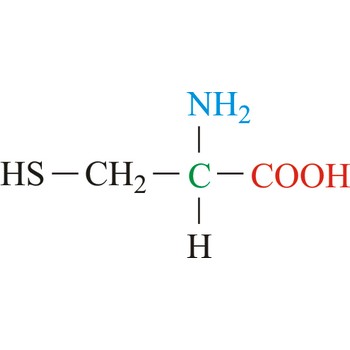
cistein → cysteine
Cistein je neutralna aminokiselina s polarnim pobočnim lancem. Zbog reaktivnosti tiolne skupine cistein ima brojne uloge u bjelančevinama. Osim što djeluje kao snažni nukleofil i ligand u kompleksima sa željezom i cinkom, najvažnije svojstvo cisteina je stvaranje disulfidne veze. Disulfidna veza igra važnu ulogu u stabilizaciji bjelančevina stvarajući čvrste veze među lancima, što je posebno važno za formiranje sekundarne i tercijarne strukture. Cistein se lako oksidira i pri tome nastaje kovalentno povezani dimer ove aminokiseline, cistin, u kojem su dvije molekule cisteina povezane disulfidnom vezom. Ostaci koji su povezani disulfidnim vezama jako su hidrofobni (nepolarni). Cistein nije esencijalna aminokiselina jer je ljudski organizam može sintetizirati.
- Kratice: Cys, C
- IUPAC ime: 2-amino-3-sulfanilpropanska kiselina
- Molekularna formula: C3H7NO2S
- Molekularna masa: 121.16 g/mol
stupanj → degree
1. Stupanj je jedinica temperature na specificiranoj skali. Temperature vrenja i smrzavanja vode na Fahrenheitovoj skali su 212 i 32 stupnja a na Celsiusovoj 100 i 0 stupnjeva.
2. Stupanj je jedinica za mjerenje kuta. Krug je podijeljen na 360 stupnjeva. Svaki stupanj je podijeljen na 60 minuta a svaka minuta na 60 sekundi. Za razliku od ostalih jedinica pisanje eksponenta jedinica za kut u ravnini piše se odmah iza broja, bez razmaka (α = 2°3'4").
3. Stupanj polinoma je najveća potencija na koju je podignuta varijabla u polinomu. Primjerice, 4x3 + 3x2 + x + 7 je polinom trećeg stupnja.
Citiranje ove stranice:
Generalić, Eni. "Maseni broj." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav