zračenje crnog tijela → blackbody radiation
Zračenje crnog tijela jest zračenje emitirano s idealnog crnog tijela, tj. tijela koje apsorbira sve zračenje koje padne na njegovu površinu. Osnovni zakon koji opisuje zračenje crnog tijela je Planckov zakon zračenja koji daje intenzitet emitiranog zračenja idealnog crnog tijela po jedinici površine u određenom smjeru kao funkciju valne duljine za određenu temperaturu. Planckov zakon može se prikazati slijedećom jednadžbom
gdje je λ valna duljina, h je Planckova konstanta, c je brzina svjetlosti, k je Boltzmannova konstanta i T je temperatura.
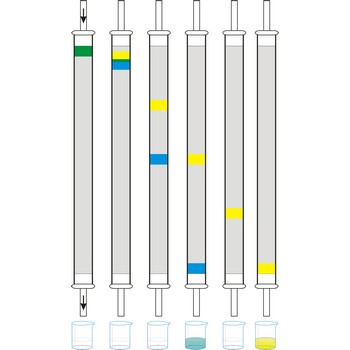
kromatografija u koloni → column chromatography
Kromatografija u koloni (na stupcu) je metoda kod koje se mobila faza kreće kroz usku cijev, pod utjecajem tlaka ili gravitacije, ispunjenu stacinarnom fazom. Kolonska kromatografija najčešće se koristi za separaciju uzorka, kako bi se izdvojila željena komponenta iz smjese. Ovisno o agregatnom stanju mobilne faze imamo plinsku (GC, gas chromatography) i tekućinsku kromatografiju (LC, liquid chromatography).
kondenzacija → condensation
1. Kondenzacija je proces u kojem plin prelazi iz plinovitog u tekuće agregatno stanje, obično je uzrokovana hlađenjem.
2. Kondenzacija u koloidnim sustavima označava proces skupljanja manjih čestica u veće čestice koloidnih dimenzija.
3. Kondenzacija je vrsta kemijske reakcije u kojoj se izdvajaju male molekule kao što su molekule vode, amonijaka, ugljikova dioksida.
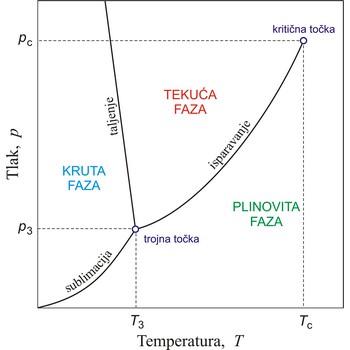
kritična temperatura → critical temperature
Kritična temperatura je maksimalna temperatura pri kojoj se plin može prevesti u tekuće stanje. Iznad kritične temperature tvar je u plinovitom agregatnom stanju neovisno o vanjskom tlaku.
kriogena frakcinacija → cryogenic fractionation
Kriogena frakcinacija proces je odvajanja plinova na način da ih se ohladi dok ne prijeđu u tekuće stanje. Ovom se metodom koriste velike kompanije pri proizvodnji tekućih plinova kao što su tekući kisik, tekući dušik itd. Plinovi imaju različitu točku vrenja (temperatura pri kojoj prelaze iz tekućeg stanja u plinovito): kisik vrije pri -183 °C, a dušik pri -195.8 °C. Znači ako zrak ohladimo, na-183 °C odvojiti će se kisik kao tekućina a dušik će ostati u plinovitoj fazi.
toplina sublimacije → heat of sublimation
Toplina sublimacije ili entalpija sublimacije jest količina topline potrebna da se jedan mol čvrste tvari prevede iz krutog u plinovito agregatno stanje bez prijelaza u tekućinu.
toplina isparavanja → heat of vaporisation
Toplina isparavanja ili entalpija isparavanja jest toplina potrebna da se tekućina prevede u plinovito stanje na temperaturi vrelišta. Izrazimo li je po jedinici mase, dobivamo specifičnu toplinu isparavanja, a ako ju izrazimo po jedinici množine tvari, dobivamo molarnu toplinu isparavanja.
ireverzibilni proces → irreversible process
Ako sistem ide iz jednog stanja u drugo i ne može se vratiti u početno stanje, takav se proces zove ireverzibilni ili nepovratni proces. Primjeri ireverzibilnih procesa jesu miješanje dvaju plinova ili tekućina, rasipanje energije trenjem i sl.
Citiranje ove stranice:
Generalić, Eni. "Jednadžba stanja idealnog plina." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav