korozija → corrosion
Korozija je štetno i nepoželjno trošenje konstrukcijskog materijala kemijskim djelovanjem okoline. Pojam korozije odnosi se i na metalne i na nemetalne konstrukcijske materijale, ali se u užem smislu često primjenjuje samo na metale. Korozija metala prema mehanizmu procesa dijeli se na kemijsku (koroziju u neelektrolitima) i elektrokemijsku (koroziju u elektrolitima).
Kemijska korozija nastaje neposrednim djelovanjem molekula nekog elementa ili spoja na metal pri čemu izravno nastaju korozijski produkti.
Elektrokemijska korozija metala zbiva se u elektrolitima pri čemu dolazi do oksidacije atoma metala u slobodni kation, koji tek sekundarnim procesima daju molekule spoja koji je produkt korozije.
ciklička voltametrija → cyclic voltammetry
Ciklička voltametrija je elektrokemijski postupak koji se koristi pri proučavanju kinetike i mehanizama elektrodnih reakcija. Potencijal radne elektrode kontrolira se i linearno mijenja u naprednom i povratnom smjeru, a pritom se mjeri struja koja protječe kroz ćeliju.
negativan pol → negative pole
Negativan pol članka je onaj polučlanak u elektrokemijskom članku koji ima negativniji elektrodni potencijal.
pozitivni pol → positive pole
Pozitivni pol je onaj polučlanak u elektrokemijskom članku koja ima pozitivniji elektrodni potencijal.
povrativi članak → reversible cell
Povrativi članak je elektrokemijski članak kod kojeg su kemijske reakcija na elektrodama reverzibilne. Akumulatori su primjer povrativog članka.
elektrodni potencijal → electrode potential
Elektrodni potencijal je potencijal elektrokemijske ćelije u kojoj je ispitivana elektroda spojena kao katoda a standardna vodikova elektroda (E = 0.000 V) kao anoda. Na katodi se uvijek događa redukcija a na anodi oksidacija.
Elektrodni potencijal je po definiciji redukcijski potencijal. Prema IUPAC-ovu dogovoru, izraz elektrodni potencijal namijenjen je isključivo za polureakcije napisane kao redukcije. Predznak elektrodnog potencijala određen je predznakom dotičnog polučlanka spojenog sa standardnom vodikovom elektrodom. Pozitivni predznak upućuje na to da je reakcija spontana u odnosu na standardnu vodikovu elektrodu, tj. da se polučlanak spontano ponaša kao katoda.
Članak za mjerenje elektrodnog potencijala sastoji se od standardne vodikove elektrode (dogovorno se piše lijevo)
i elektrode ispitivanog redoks-sustava (dogovorno se piše desno)
i može se shematski napisati kao
Elektromotorna sila (e.m.f.) ispitivanog redoks sustava jednaka je
Dogovorno je uzeto da je pri p(H2) = 101325 Pa i a(H+) = 1.00, potencijal vodikove elektrode jednak je 0.000 V pri svim temperaturama. Posljedica je takve definicije da se ukupni potencijal svakoga galvanskog članka koji sadrži standardnu vodikovu elektrodu pripisuje drugoj elektrodi
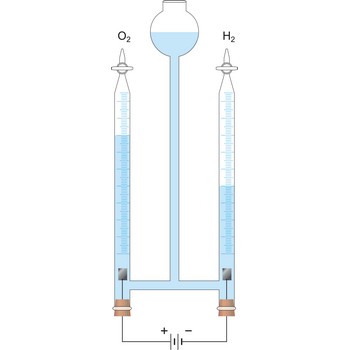
elektroliza → electrolysis
Elektroliza je elektrokemijski proces pri kojem se uz pomoć vanjskog izvora struje na elektrodama (katodi i anodi) vrše reakcije oksidacije i redukcije.
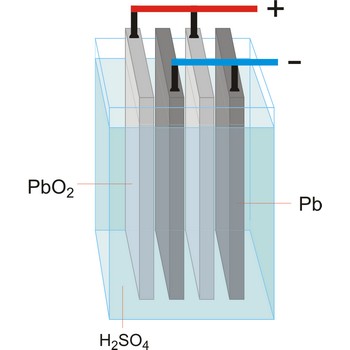
elektrolitska ćelija → electrolytic cell
Elektrolitska ćelija je ćelija u kojoj se električna energija pretvara u kemijsku. Kemijske reakcije se ne dešavaju spontano, već se odvijaju na račun struje koju u ćeliju šalje vanjski izvor i vrši elektrolizu. Promjena slobodne Gibbsove energije ukupnog procesa pozitivna je. Koriste se za elektrolizu tvari ili za spremanje električne energije pretvorbom u kemijsku (akumulatori).
litij → lithium
Litij je 1817. godine otkrio Johan August Arfvedson (Švedska). Ime su mu dali Arfvedson i Berzelius od grčke riječi lithos što znači stijena jer je litij otkriven u stijenama za razliku od druga dva elementa prve skupine, kalija i natrija, koji su dobiveni iz biljnog materijala. To je mekani, srebrno bijeli metal koji sporo reagira s kisikom iz zraka. Može se zapaliti na zraku, a u reakciji s vodom razvija vodik iako manje burno nego natrij. Litij je najjače redukcijsko sredstvo. Rijetko se nalazi u većim koncentracijama. Najčešće se javlja u obliku aluminosilikata kao što je spodumen (LiAlSi2O6). Litij je najlakši metal. Upotrebljava se za legiranje aluminija i za izradu specijalnih stakala i keramike. Zbog svog velikog elektrokemijskog potencijala koristi se kao anoda u baterijama.
solni most → salt bridge
Solni most osigurava električni kontakt između dviju otopina bez njihovog miješanja. Solni most sastoji se od poroznog materijala koji je natopljen otopinom soli i koji dopušta ionima da prijeđu iz jedne posude u drugu. Otopina soli ostaje nepromijenjena tijekom ovog prijenosa.
Citiranje ove stranice:
Generalić, Eni. "Elektrokemijski niz." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav