kemijski potencijal → chemical potential
Za smjesu tvari, kemijski je potencijal komponente B (μB) definiran kao parcijalna derivacija Gibbsove energije (G) s obzirom na količinu (broj molova) komponente B, kada se temperatura, tlak i količina ostalih komponenti drži konstantnim.
Kemijski potencijal komponenti u ravnoteži jednak je.
Clapeyronova jednadžba → Clapeyron equation
Clapeyronova jednadžba (poznata i kao Clausius-Clapeyronova jednadžba) jest odnos između tlaka i temperature za dvije faze čiste tvari koje su u ravnoteži,
gdje je ΔS razlika entropije između faza a ΔV je rezultirajuća razlika volumena.
teorija sudara → collision theory
Teorija sudara je teorija koja objašnjava kako se događaju kemijske reakcije i zašto se mijenja brzina reakcije. Da bi se reakcija dogodila moraju se molekule reaktanta sudariti. Samo dio sudara, uspješni sudari, uzrokuje kemijske promjene. Uspješni sudari imaju dovoljno energije (aktivacija energija) u trenutku sudara da prekinu postojeće veze i stvore nove veze, stvarajući reakcijske produkte. Povećavanje koncentracije reaktanata i povišenje temperature povećava broj sudara, odnosno dovodi do povećanja brzine reakcije.
kritična točka → critical point
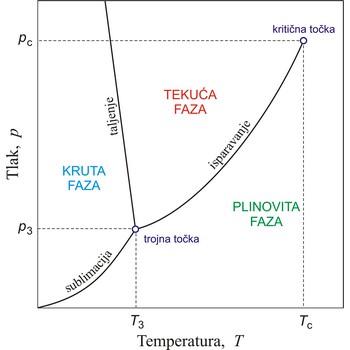
Kritična točka je točka na faznom dijagramu dvofaznog sustava u kojoj dvije faze imaju jednaka svojstva i zbog toga čine jednu fazu. U kritičnoj točki za tekuću i plinovitu fazu čiste tvari nestaje razlika između tekućine i plina i u njoj završava krivulja napona pare. Koordinate ove točke jesu kritična temperatura i kritični tlak. Iznad kritične temperature fluid se ne može ukapljiti.
mehanika fluida → fluid mechanics
Mehanika fluida bavi se proučavanjem različitih svojstava fluida (tekućina i plinova): brzine, tlaka, gustoće i temperature kao funkcije prostora i vremena.
frakcijska kristalizacija → fractional crystallisation
Frakcijska kristalizacija metoda je razdvajanja smjese topljivih spojeva. Smjesa se otopi u toplom otapalu a potom se postepeno snižava temperatura. Najmanje topljiva komponenta će se prva iskristalizirati ostavljajući ostale u otopini. Pažljivim odabirom otapala i kontrolom temperature ponekad je moguće ukloniti komponente jednu po jednu.
smrzavanje → freezing
Smrzavanje je promjena iz tekućeg u kruto stanje smanjenjem temperature. Za vodu točka smrzavanja jest 0 °C (ili 273.16 K).
ledište → freezing point
Ledište je temperatura pri kojoj tekućina prelazi u čvrsto agregatno stanje pri normalnom tlaku.
Vidi Talište
kriogenski fluid → cryogenic fluid
Kriogenski fluidi upotrebljava se za postizanje niskih temperatura. Njegovim naglim isparavanjem postižu se kriogenske temperature, obično ispod -150 °C. Najčešći kriogenski fluid koji se koristi u laboratoriju jest tekući dušik (-196 °C). Oblak koji se stvara pri radu s tekućim dušikom nastaje kondenziranjem vodene pare iz zraka. Osim tekućeg dušika upotrebljavaju se još i tekući helij (-269 °C), vodik (-253 °C), argon (-186 °C), kisik (-183 °C) i metan (-161 °C).
kriogena frakcinacija → cryogenic fractionation
Kriogena frakcinacija proces je odvajanja plinova na način da ih se ohladi dok ne prijeđu u tekuće stanje. Ovom se metodom koriste velike kompanije pri proizvodnji tekućih plinova kao što su tekući kisik, tekući dušik itd. Plinovi imaju različitu točku vrenja (temperatura pri kojoj prelaze iz tekućeg stanja u plinovito): kisik vrije pri -183 °C, a dušik pri -195.8 °C. Znači ako zrak ohladimo, na-183 °C odvojiti će se kisik kao tekućina a dušik će ostati u plinovitoj fazi.
Citiranje ove stranice:
Generalić, Eni. "Celsius temperature scale." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav