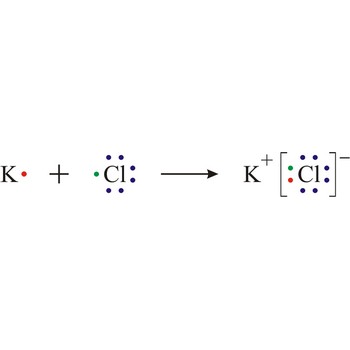ionska veza → ionic bond
Ionska veza predstavlja jaku silu koja drži atome zajedno u molekuli ili kristalu. Energija veze je oko 100 kJ mol-1. Ionska veza je takva veza kod koje jedan od sudionika, za vrijeme vezanja, predaje svoje nesparene elektrone drugom atomu tako da oba postignu elektronski raspored najbližeg plemenitog plina. Da bi nastala ionska veza između atoma, mora jedan od atoma prijeći u pozitivno nabijen ion gubitkom određenog broja elektrona, a drugi atom mora primiti te elektrone i prijeći u negativno nabijen ion.
spektar X-zraka → X-ray spectrum
Spektar X-zraka je skupina karakterističnih frekvencija za x-zrake ili valnih duljina valova koje proizvode materijali koji su postavljeni kao meta u cijevima u kojima se emitiraju X-zrake. Svaki element ima za sebe karakterističan spektar X-zraka. Postoji i jaka veza između atomskog broja i frekvencije pojedine linije u spektru X-zraka.
lantanoidi → lanthanides
Lantanoidi ili lantanidi su smješteni unutar 6. periode u 3. podljusci. Imaju nepopunjene niže f-podljuske te se stoga nazivaju unutrašnjim prijelaznim elementima ili f-elementima. U skupinu lantanoida spadaju elementi od rednog broja 58. do rednog broja 71., a često se u lantanoide svrstava i lantan (La). Zbog vrlo sličnih svojstava vrlo teško ih je razdvojiti. Dijelimo ih na cerijevu skupinu ili lake lantanoide: cerij (Ce), praseodimij (Pr), neodimij (Nd), prometij (Pm), samarij (Sm), europij (Eu); i itrijevu skupinu ili teške lantanoide: gadolinij (Gd), terbij (Tb), disprozij (Dy), holmij (Ho), erbij (Er), tulij (Tm), iterbij (Yb) i lutecij (Lu). Lantanoidi se ponekad nazivaju i rijetke zemlje. Osim radioaktivnog prometija ostali lantanoidi i nisu tako rijetki. Cerij je primjerice na 26. mjestu najčešćih elementa u zemljinoj kori i ima ga pet puta više nego olova.
periodni sustav elemenata → periodic table of the elements
Periodni sustav elemenata jest tablica u kojoj su svi elementi složeni na temelju fizičkih i kemijskih svojstava. Elementi su svrstani u 18 vertikalnih skupina i 7 horizontalnih perioda. Svaka skupina (kolona tablice) sadrži elemente koji imaju slična svojstva. Broj koji određuje položaj elementa u periodnom sustavu, odnosno vrstu atoma, naziva se redni ili atomski broj. Svojstva elemenata periodična su funkcija njihovog rastućeg atomskog broja. Originalna tablica, koju je predstavio 1869. ruski kemičar D. I. Mendeljejev (1834.-1907.), bila je složena po rastućim atomskim masama (uz neke iznimke).
polisaharid → polysaccharide
Polisaharidi su spojevi koji se sastoje od velikog broja jednostavnih šećera (monosaharida) povezanih glikozidnom vezom. Polisaharidi sastavljeni samo od jedne vrste monosaharida nazivaju se homopolisaharidi a oni od više različitih vrsta heteropolisaharidi. Polisaharidi su često vrlo razgranate molekule s molekularnom masom od nekoliko milijuna. Kako imaju samo jednu slobodnu poluacetalnu skupinu na kraju dugog lanca polisaharidi ne pokazuju primjetnu reakciju na aldehide niti mutarotaciju. Najvažniji su predstavnici celuloza, škrob i glikogen.
značajne znamenke → significant figures
Mjerenja nikad nisu beskrajno točna i mora se procijeniti mjera njihove neizvjesnosti. U nekom podatku mjerenja sve sigurne i prva nesigurna znamenka značajne su.
Pravila za određivanje značajnih znamenki jesu:
- Sve nule na početku broja zanemaruju se
- Sve nule na kraju broja zanemaruju se osim ako nisu iza decimalnog zareza
- Sve ostale znamenke, uključujući nulu između brojaka koje nisu nule, značajne su
Tako npr. broj
| 0.0023 | ima dvije značajne znamenke |
| 0.109 | ima tri značajne znamenke |
| 2.00 | ima tri značajne znamenke |
| 70 | ima jednu značajnu znamenku |
Rezultat treba imati samo značajne znamenke.
Prilikom zbrajanja i oduzimanja rezultat može imati onoliko znamenki iza decimalnog zareza koliko ih ima podatak s najmanjim brojem decimala (s najvećom apsolutnom pogreškom).
U množenju i dijeljenju rezultat treba imati onoliko značajnih znamenki koliko ih ima podatak s najmanjim brojem značajnih znamenki (s najvećom relativnom pogreškom). Ovo pravilo valja primijeniti s oprezom.
U logaritmu broja zadrži se onoliko znamenki desno od decimalnog zareza koliko je značajnih znamenki u izvornom broju
U antilogaritmu broja zadrži se onoliko znamenki koliko je znamenki desno od decimalnog zareza u izvornom broju.
valni broj → wavenumber
Valni broj je broj valnih ciklusa po jedinici udaljenosti. Na nesreću postoje dvije definicije valnog broja.
Valni broj, k, najčešće se definira kao
gdje je λ valna duljina, vp fazna brzina vala a ω kružna frekvencija.
Manje česta definicija valnog broja je
Uvijek se mora naglasiti koja se definicija koristi. Naširoko se koriste kod infracrvene spektroskopije i obično se izražavaju u cm-1.
Citiranje ove stranice:
Generalić, Eni. "Geigerov brojač." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav