metal → metal
Metali ili kovine čine više od dvije trećine svih elemenata koji se mogu naći u prirodi. Od 114 poznatih elemenata, samo 17 su nemetali, 7 su polumetali a ostalih 89 mogu se svrstati u metale.
Metali su neprozirni, imaju karakterističan metalni sjaj, dobri su vodiči topline i električne struje. Električna vodljivost metala općenito opada porastom temperature.
Većina se metala može dobro kovati i istezati. Na sobnoj su temperaturi svi, osim žive, u čvrstom stanju. Mogu se koristiti u čistom stanju, ali se češće miješaju s drugim metalima i nemetalima u legure.
mol → mole
Mol (mol) je osnovna SI jedinica za količinu (množinu) tvari.
Mol je količina tvari onog sustava koji sadrži toliko elementarnih jedinki tvari koliko ima atoma u 0.012 kg izotopa ugljika 12 (12C).
Elementarne jedinke uvijek moraju biti specificirane i mogu biti atomi, molekule, ioni, elektroni, neke druge čestice ili određene grupe čestica. U jednom molu (0.012 kg) izotopa ugljika 12 ima 6.022 045×1023 atoma (Avogadrov broj).
Nernstov zakon razdjeljenja → Nernst’s division law
Nernstov zakon razdjeljenja kaže da se tvar raspodjeljuje između dva otapala tako da je omjer koncentracija te tvari pri nekoj temperaturi stalan, uz uvjet da se u oba otapala tvar nalazi u istom molekularnom obliku. Koeficijent razdjeljenja odnos je koncentracija tvari u otapalima A i B na određenoj temperaturi.
Pojava razdjeljenja iskorištava se za ekstrakciju tvari.
nemetal → non-metal
Nemetali su elementi koji ne pokazuju metalna svojstva (slabi su vodiči topline i električne struje, ne daju se kovati itd.). Njihove se molekule uglavnom sastoje od kovalentno vezanih atoma osim kod idealnih plinova koji su monoatomni.
Smješteni su skroz desno u periodnom sustavu. Oksidi nemetala otapanjem u vodi daju kiseline. Nemetali imaju skoro popunjenu vanjsku ljusku s elektronima i lako se spajaju jedan s drugim ili s metalima. Kod mnogih elemenata ove grupe susrećemo alotropiju.
pravilo okteta → octet rule
Pravilo okteta kaže da se kemijska svojstva elemenata redovito ponavljaju s porastom atomske mase i da su svojstva svakog osmog elementa slična. Budući da svi plemeniti plinovi osim helija imaju po osam elektrona u svojoj vanjskoj ljusci, takva se stabilna elektronska konfiguracija zove pravilo okteta. U kemijskim reakcijama atomi elemenata imaju tendenciju da reagiraju na način da postignu elektronsku konfiguraciju plemenitog plina koji im je najbliži u periodnom sustavu elemenata. Postoji mnogo iznimaka ovog pravila.
oksidacijski broj → oxidation number
Atomi mogu u vezu angažirati jedan ili više elektrona. Valenciju atoma, koja proizlazi iz stehiometrijskog odnosa međusobno spojenih atoma, nazivamo stupnjem oksidacije ili oksidacijskim brojem. Oksidacijski broj atoma u elementarnom je stanju nula. Atom veće elektronegativnosti ima negativan, a atom manje elektronegativnosti pozitivan oksidacijski broj.
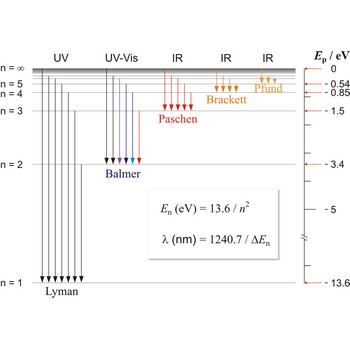
Paschenova serija → Paschen series
Paschenova serija jest serija linija u spektru vodikova atoma koja nastaje skokom elektrona iz viših energijskih nivoa u normalno stanje s kvantnim brojem n = 3.
plazma → plasma
Plazma je visoko ionizirani plin u kojem je naboj elektrona uravnotežen s nabojem pozitivnih iona, tako da je sustav u cjelini električno neutralan. Plazma se stvara na način da se plinovi izlažu električnom ili elektromagnetskom polju pri niskom tlaku. U proizvodnji poluvodiča koristi se za graviranje (jetkanje) i deponiranje tankog filma (ekscitirano stanje je čini vreoma reaktivnom). U svakidašnjem životu plazma se koriste za dobivanje svjetla u žaruljama, neonkama i plavim klopkama za kukce.
potencijalna energija → potential energy
Potencijalna energija (Ep) jest energija pohranjena unutar tijela ili sustava kao posljedica mjesta, oblika ili stanja (uključuje gravitacijsku, električnu, nuklearnu i kemijsku energiju). Gravitacijska potencijalna energija je energija povezana sa stanjem razdvojenosti tijela koja se međusobno privlače gravitacijskom silom. Elastična potencijalna energija povezana je sa stanjem sabijenosti ili rastegnutosti elastičnog tijela (poput opruge). Toplinska energija povezana je s nasumičnim gibanjem atoma i molekula u tijelu.
Citiranje ove stranice:
Generalić, Eni. "50 states program guide." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav