kemijski potencijal → chemical potential
Za smjesu tvari, kemijski je potencijal komponente B (μB) definiran kao parcijalna derivacija Gibbsove energije (G) s obzirom na količinu (broj molova) komponente B, kada se temperatura, tlak i količina ostalih komponenti drži konstantnim.
Kemijski potencijal komponenti u ravnoteži jednak je.
van der Waalsov radijus → van der Waals’s radius
Van der Waalsov radijus jest jedna polovina udaljenosti između dva međusobno nevezana atoma, u onom trenutku kad su odbojne i privlačne sile među njima izjednačene.
nulti zakon termodinamike → zero law of thermodynamics
Nulti zakon termodinamike glasi: Ako je neko tijelo A u toplinskoj ravnoteži s tijelom B i s tijelom C, onda su i tijela B i C u međusobnoj toplinskoj ravnoteži.
klorinitet → chlorinity
Klorinitet (simbol Cl) je definiran kao ukupna količina halida (klorida, bromida i jodida) u 1 kg mora, a da su pri tome jodid i bromid zamijenjeni ekvivalentnom količinom klorida. Kako bi se napravio neovisnim o promjenama atomskih masa halida, klorinitet se danas definira kao masa čistog srebra potrebna da se istalože svi kloridi, bromidi i jodidi pomnožena s 0.37285233. Klorinitet se općenito određuje kako bi se izračunala slanost (salinitet) mora.
Klorinitet se određuje Mohrovom metodom, jednom od najstarijih metoda titracije - uveo ju je 1856. njemački kemičar Karl Friedrich Mohr (1806.-1879.), titracijom uzorka mora sa standardnom otopinom srebrovog nitrata (AgNO3) uz kalijev kromat (K2CrO4) kao indikator.
pri tome se uz AgCl talože još i AgBr i AgI.
Problem kod Mhorove titracije je u tome što srebrov nitrat nije primarni standard. Kako bi ovo izbjegao i omogućio da sva mjerenja saliniteta budu usporediva, predsjednik Međunarodnog povjerenstva za istraživanje mora (ICES, International Council for the Exploration of the Sea), danski fizičar Martin Knudsen (1871.-1949.) definirao je kao standard Normalnu vodu (Eau de mer Normale) stalnog sastava s točno određenim klorinitetom (oko 19.38 ‰). Ova voda je potom korištena za standardizaciju otopine srebrova nitrata. Na taj način sva određivanja kloriniteta referirala su se na isti standard što je omogućilo da svi rezultati budu usporedivi. Upotrebom Normalne vode, Knudsenove pipete i birete za analizu te Hidrografskih tablica dobivali su se rezultati točnosti usporedive onima dobivenim gravimetrijom.
Mjerenjem saliniteta i kloriniteta u devet uzoraka mora iz različitih dijelova svijeta Knudsen je, 1889., došao do empirijske formule za određivanje saliniteta:
Ova formula koristila se do 1962., kada je Zajedničko vijeće za oceanografske tablice i standarde (JPOTS, Joint Panel for Oceanographic Tables and Standards) odredilo novu konstantu proporcionalnosti u Knudsenovoj formuli
zapaljiv → combustible
Termin zapaljiv često se upotrebljava kad se opisuje materijal koji gori. Ipak se uvjeti pri kojem dolazi do zapaljenja nastoje točnije definirati, npr. zapaljiva je tekućina ona koja se može zapaliti iznad 37.8 °C ali ispod 93.3 °C. Ovo omogućava razliku između materijala koje je prilično teško zapaliti i onih koje je jako lako zapaliti.
konformacija → conformation
Konformacije su različiti oblici molekula koji su posljedica rotacije dijela molekule oko jednostruke veze. Konformacijski izomeri, za razliku od geometrijskih izomera, ne mogu se izolirati i odvojiti, jer oni mogu slobodno prelaziti iz jednoga izomera u drugi.
Imamo dva ekstremna slučaja:
Nezasjenjena konformacija (antiperiplanarna) je takva konformacija kod koje su atomi vezani za jedan ugljikov atom maksimalno udaljeni od onih vezanih za drugi ugljikov atomu.
Zasjenjena konformacija (sin-periplanarna) je takva konformacija u kojoj atomi vezani za jedan ugljikov atom pokrivaju (zasjenjuju) one vezane za drugi ugljikov atom.
Nezasjenjena konformaacija stabilnija je od zasjenjene.
Daltonov zakon → Dalton’s law
Daltonov zakon parcijalnih tlakova kaže da je ukupni tlak smjese plinova jednak zbroju parcijalnih tlakova svih plinova koji čine tu smjesu pod uvjetom da međusobno ne reagiraju.
Npr. ako se suhi kisik koji ima tlak od 900 hPa zasiti vodenom parom koja ima tlak od 56 hPa, onda je tlak vlažnog kisika 956 hPa.
dioksin → dioxin
Dioksini su organski spojevi koji pripadaju u grupu polikloriranih ugljikovodika, točnije polikloriranih bifenila. Najopasniji od njih je TCDD (2,3,7,8-tetraklorodibenzo-p-dioksin) ili jednostavno dioksin. Dioksin nastaje izgaranjem mnoštva organskih tvari, često i organskih otpadaka prilikom spaljivanja otpada, a i kao nusprodukt u raznim kemijskim procesima u organskoj kemijskoj industriji. U tragovima ga je bilo u poznatoj kemikaliji Agent Orange koja se upotrebljavala u Vijetnamskom ratu za defolijaciju šuma. Također je poznat iz incidenta u Tvornici kemijskih proizvoda u Sevesu u Italiji gdje je dioksin onečistio okolinu.
Dioksini su kemijski stabilni, netopljivi u vodi, ali vrlo lako topljivi u mastima i uljima. Istraživanja potaknuta tvrdnjama da je herbicid štetio vijetnamskim veteranima i radnicima u kemijskoj industriji potvrdila su visoku toksičnost, teratogenost, kancerogenost i mutagenost dioksina. U posljednje vrijeme objavljeni su i radovi u kojima se upozorava da se i neki spojevi iz ispušnih plinova automobila ponašaju slično dioksinu.
Strukturna formula izgleda ovako:
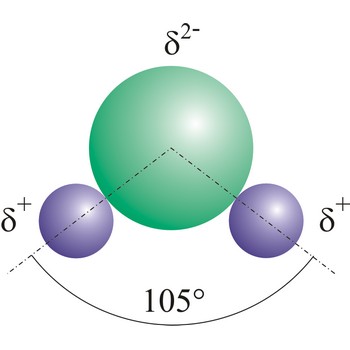
dipol → dipole
Dipol je čestica koja sadrži par odvojenih suprotnih naboja na konačnoj udaljenosti. Ako molekula sadrži spojene atome različitog afiniteta za elektrone, onda je veća gustoća elektrona oko atoma većeg afiniteta za elektrone. Time dolazi do asimetrične raspodjele negativnog naboja u molekuli, tj. jedan dio molekule postaje relativno negativno nabijen (kome je bliži elektronski par) a drugi postane relativno pozitivno nabijen. Takav dipolni karakter imaju molekule klorovodika (HCl), vode (H2O) i amonijaka (NH3) jer atomi klora, kisika i dušika imaju veći afinitet za elektrone nego atomi vodika.
dipolna molekula → dipole molecule
Dipolne molekule nastaju kad zajednički elektronski par kod kovalentne veze nije simetričan. Ukoliko se kovalentnom vezom vežu raznovrsni atomi, koji mogu imati različit afinitet za elektrone, onda atom s većim afinitetom jače privuče elektronski par. Time dolazi do asimetrične raspodjele negativnog naboja u molekuli, čime jedan dio molekule postaje relativno negativno nabijen (kome je bliže elektronski par) a drugi relativno pozitivno nabijen.
Citiranje ove stranice:
Generalić, Eni. "ハンドサイン one two three 英語." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav