mol → mole
Mol (mol) je osnovna SI jedinica za količinu (množinu) tvari.
Mol je količina tvari onog sustava koji sadrži toliko elementarnih jedinki tvari koliko ima atoma u 0.012 kg izotopa ugljika 12 (12C).
Elementarne jedinke uvijek moraju biti specificirane i mogu biti atomi, molekule, ioni, elektroni, neke druge čestice ili određene grupe čestica. U jednom molu (0.012 kg) izotopa ugljika 12 ima 6.022 045×1023 atoma (Avogadrov broj).
Nernstov zakon razdjeljenja → Nernst’s division law
Nernstov zakon razdjeljenja kaže da se tvar raspodjeljuje između dva otapala tako da je omjer koncentracija te tvari pri nekoj temperaturi stalan, uz uvjet da se u oba otapala tvar nalazi u istom molekularnom obliku. Koeficijent razdjeljenja odnos je koncentracija tvari u otapalima A i B na određenoj temperaturi.
Pojava razdjeljenja iskorištava se za ekstrakciju tvari.
otopina → solution
Otopine su homogene smjese čistih tvari. Otopine sadrže dvije ili više tvari pomiješanih u stanju molekulske disperzije. Komponenta koja se nalazi u otopini u većoj količini od ostalih komponenata naziva se otapalo, a ostale komponente nazivaju se otopljenim tvarima. Otopina može biti nezasićena, zasićena i prezasićena.
prezasićena otopina → supersaturated solution
Prezasićena otopina je ona otopina koja sadrži veću količinu otopljene tvari nego što to odgovara topljivosti te tvari na danoj temperaturi. To je nestabilno stanje i već protresanjem otopine može doći do izlučivanja viška otopljene soli.
nemetal → non-metal
Nemetali su elementi koji ne pokazuju metalna svojstva (slabi su vodiči topline i električne struje, ne daju se kovati itd.). Njihove se molekule uglavnom sastoje od kovalentno vezanih atoma osim kod idealnih plinova koji su monoatomni.
Smješteni su skroz desno u periodnom sustavu. Oksidi nemetala otapanjem u vodi daju kiseline. Nemetali imaju skoro popunjenu vanjsku ljusku s elektronima i lako se spajaju jedan s drugim ili s metalima. Kod mnogih elemenata ove grupe susrećemo alotropiju.
pravilo okteta → octet rule
Pravilo okteta kaže da se kemijska svojstva elemenata redovito ponavljaju s porastom atomske mase i da su svojstva svakog osmog elementa slična. Budući da svi plemeniti plinovi osim helija imaju po osam elektrona u svojoj vanjskoj ljusci, takva se stabilna elektronska konfiguracija zove pravilo okteta. U kemijskim reakcijama atomi elemenata imaju tendenciju da reagiraju na način da postignu elektronsku konfiguraciju plemenitog plina koji im je najbliži u periodnom sustavu elemenata. Postoji mnogo iznimaka ovog pravila.
oksidacijski broj → oxidation number
Atomi mogu u vezu angažirati jedan ili više elektrona. Valenciju atoma, koja proizlazi iz stehiometrijskog odnosa međusobno spojenih atoma, nazivamo stupnjem oksidacije ili oksidacijskim brojem. Oksidacijski broj atoma u elementarnom je stanju nula. Atom veće elektronegativnosti ima negativan, a atom manje elektronegativnosti pozitivan oksidacijski broj.
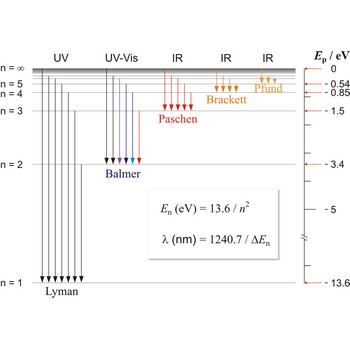
Paschenova serija → Paschen series
Paschenova serija jest serija linija u spektru vodikova atoma koja nastaje skokom elektrona iz viših energijskih nivoa u normalno stanje s kvantnim brojem n = 3.
Citiranje ove stranice:
Generalić, Eni. "States of matter." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav