saharoza → sucrose
Saharoza, poznata kao običan šećer, je disaharid u kojem su α-D-glukopiranoza i β-D-fruktofuranoza povezane glikozidnom vezom preko svojih anomernih ugljikovih atoma. Saharoza nema slobodnih poluacetalnih skupina pa ne pokazuje reakcije na aldehide (saharoza je nereducirajući šećer) niti mutarotaciju. Saharoza je slatka bijela kristalinična tvar koja se nalazi u mnogim biljkama a komercijalno se dobiva iz šećerne trske i šećerne repe. Koristi se kao zaslađivač u industriji hrane i piće. Zagrijavanjem saharoze na 200 °C nastaje smeđe obojeni karamel. Hidrolizom saharoze nastaje jednaka količina glukoze i fruktoze, tzv. invertni šećer. Pčele imaju enzim invertazu koji katalizira hidrolizu sharoze na jednostavne šećere. Med se, u stvari, sastoji uglavnom od glukoze, fruktoze i saharoze.
šećer → sugar
Šećeri su skupina u vodi topljivih ugljikohidrata relativno niske molekularne mase i karakterističnog slatkog okusa. Skupinu čine uglavnom monosaharidi (glukoza, fruktoza, galaktoza), disaharidi (saharoza, laktoza, maltoza) i trisaharidi (rafinoza). Mnogi od njih se često nalaze u prirodi i nose imena koja odražavaju odakle su prvi put izolirani. Primjerice glukoza je također poznata i kao grožđani šećer, fruktoza kao voćni šećer, laktoza kao mliječni šećer a maltoza kao sladni šećer. U svakodnevnoj upotrebi ime šećer se obično odnosi na saharozu (obični stolni šećer iz šećerne trske ili šećerne repe).
superkritični fluid → supercritical fluid
Superkritični fluid je bilo koja tvar iznad svoje kritične temperature i kritičnog tlaka (vidi fazni dijagram). On ima jedinstvena svojstva koja se razlikuju i od plinova i od tekućina. Superkritični fluid ima svojstvo plina da penetrira u svaku poru kao i svojstvo tekućine da otapa materijale. Topljivost tvari raste s porastom gustoće (tj. s porastom tlaka). Primjerice, naftalen je praktički netopiv u niskotlačnom tekućem ugljičnom dioksidu. Na 100 bar topljivost je 10 g/L a na 200 bar je 50 g/L. Brzom ekspanzijom superkritične otopine dolazi do taloženja otopljene krutine.
T-oblik geometrije molekule → T-shaped molecular geometry
T-oblik molekule imaju molekule koje oko centralnog atoma imaju tri veze i 2 slobodna elektronska para. Atomi vezani na centralni atom leže na krajevima slova T s kutovima od 90° između njih. Elektronske orbitale usmjerene u vrhove trigonske bipiramide posljedica su sp3d (ili dsp3) hibridizacije na centralnom atomu. ICl3 ima T-oblik molekule.
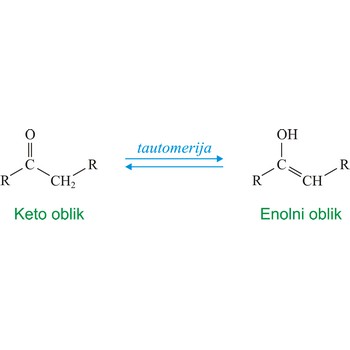
tautomerija → tautomerism
Tautomerija je izraz koji se odnosi na ravnotežu dviju različitih struktura istog spoja. Obično se tautomeri razlikuju u mjestu spajanja vodikovog atoma. Najčešći primjer tautomernog sustava je ravnoteža između ketona (keto) i aldehida (enol).
tetragonski kristalni sustav → tetragonal crystal system
U tetragonskom kristalnom sustavu sve tri kristalografske osi okomite su. Dvije vodoravne osi su jednake duljine a treća je duža ili kraća od njih.
a = b ≠ c
α = β = γ = 90°
tetraedarska geometrija molekule → tetrahedral molecular geometry
Tetraedarska geometrija molekule onaj je oblik kod kojeg u molekuli postoje četiri veze na centralnom atomu bez slobodnih elektronskih parova. Atomi vezani na centralni atom leže na vrhovima tetraedra s kutom od 109.5° između njih. Tetraedarski raspored elektronskih orbitala posljedica je sp3 hibridizacije na centralnom atomu. Npr. amonijev ion (NH4+) i metan (CH4) imaju tetraedarsku geometriju molekule.
termometar → thermometer
Termometri su sprave za mjerenje temperature. Linearno i volumensko toplinsko rastezanje makroskopska su svojstva tvari i lakše su mjerljiva od mikroskopskih svojstava, kojima se definira temperatura. Stoga se mjerenjem tih svojstava može odrediti temperatura. Termometri koji se zasnivaju na toplinskom rastezanju tvari su sekundarni instrumenti: moraju se baždariti, tako da se usporede s nekim standardnim termometrom. U termometru s tekućinom, živa ili alkohol se nalaze u staklenoj posudici. Povećanjem temperature povećava se volumen tekućine, što uzrokuje podizanje tekućine uskom kapilarnom cjevčicom. Visina razine tekućine u cjevčici je mjera temperature. Živinim termometrom mjere se temperature između -39 °C i 300 °C. Niže temperature mjere se alkoholnim termometrom. Bimetalni termometri imaju spiralnu oprugu sastavljenu od dva metala, različitih koeficijenata linearnog rastezanja. Promjenom temperature metali se različito produžuju pa se savijanje spirale prenosi na kazaljku, čiji otklon je mjera temperature.
termosfera → thermosphere
Termosfera je sloj Zemljine atmosfere koji se proteže od mezosfere (80 km - 90 km iznad površine) do oko 500 km. Karakteriziran je brzim rastom temperature s porastom visine do oko 200 km, a zatim se izjednačava u području od 300 km do 500 km.
Citiranje ove stranice:
Generalić, Eni. "Period." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav