paladij → palladium
Paladij je 1803. godine otkrio William Hyde Wollaston (Engleska). Ime je dobio prema asteroidu Pallasu koji je otkriven u to vrijeme nazvanom po grčkoj boginji mudrosti - Pallas. To je sjajni, srebrno bijeli metal koji zajedno s rutenijem i rodijem čini skupinu lakih platinskih metala. Kad je čist, kovak je i savitljiv dok mu hladnom obradom tvrdoća jako poraste. Otporan je na koroziju. Topljiv je u nitratnoj kiselini, vrućoj koncentriranoj sulfatnoj kiselini, zlatotopci i talinama alkalija. Apsorbira velike količine vodika. Na sobnoj temperaturi apsorbira 600 puta veći volumen od svog, a na povišenoj temperaturi još i više. Metalni prah je zapaljiv. U prirodi se pojavljuje obično kao pratitelj bakarnih i nikalnih ruda, ili u aluvijalnim ležištima. Polovina masenog udjela platinskih metala u Zemljinoj kori otpada na paladij. Upotrebljava se kao katalizator za hidrogeniranje i dehidrogeniranje. Legura zlata i paladija, bijelo zlato, se koristi za izradu nakita. Velike količine paladija upotrebljavaju se za izradu električnih kontakata.
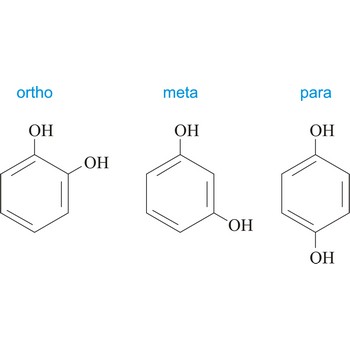
para položaj → para position
Para položaj u organskoj kemiji je onaj položaj u kojem su na benzenov prsten vezane dvije skupine u položaju 1 i 4. Upotrebljava se kratica p-, npr. p-hidrokinon je 1,4-dihydroxybenzene.
fosfor → phosphorus
Fosfor je 1669. godine otkrio Hennig Brandt (Njemačka). Ime mu dolazi od grčke riječi phosphoros što znači donošenje (rađanje) svjetlosti. Fosfor se javlja u tri alotropske modifikacije. Bijeli fosfor je bijela do žuta mekana voštana krutina s nagrizajućim parama koja se ne otapa u vodi ali se otapa u mastima i uljima. Na zraku se sam od sebe zapali. Mekan je a u mraku svjetluca. Crveni fosfor je stabilan i netopljiv u svim otapalima. Crni fosfor je vrlo postojana krutina metalnog sjaja. Crveni fosfor nije otrovan, dok je bijeli vrlo otrovan. Udisanje njegovih para je, i u vrlo malim količinama, smrtonosno. U dodiru s kožom izaziva duboke opekline koje teško zarastaju. U prirodi se najčešće javlja u mineralima fosforitu (Ca3(PO4)2) i apatitu (3Ca3(PO4)2·Ca(ClF)2). Dobiva se iz fosforita prženjem s kvarcnim pijeskom i ugljenom u električnim pećima. Bijeli fosfor se upotrebljava kao otrov za štakore, a crveni u industriji šibica.
fotoelektrični efekt → photoelectric effect
Fotoelektrični efekt je pojava da se osvjetljivanjem pločica nekih metala oslobađaju elektroni. Kvante svjetlosti koji padnu na metalnu ploču metal apsorbira i energija fotona pretvara se u energiju fotoelektrona. Dio apsorbirane energije utroši se za izbacivanje elektrona iz metala, a preostali dio ostaje kao kinetička energija fotoelektrona. Energija fotona (hν) prema Einsteinovoj fotoelektričnoj jednadžbi jest
dekapiranje → pickling
Dekapiranje je čišćenje kovina, uglavnom čeličnih limova, od okujine i rđe, uronjavanjem u razrijeđenu sumpornu (w(H2SO4) = 10 %) ili solnu kiselinu pri određenoj temperaturi (80 °C). Otopini se dodaje inhibitor radi sprječavanja piting korozije metala.
platina → platinum
Platinu je 1735. godine otkrio Antonio de Ulloa (Južna Amerika). Ime je dobila po španjolskoj riječi platina što znači srebro. To je sjajni, srebrno bijeli metal. Kad je čist, kovak je i savitljiv. Zajedno s iridijem i osmijem čini skupinu teških platinskih metala. Platina se na zraku, nezaštićena, može zagrijavati na bilo koju temperaturu a da ne oksidira. Otporna je na sve kiseline osim zlatotopke. Pri povišenoj temperaturi reagira s talinama alkalija. U prirodi se pojavljuje obično kao pratitelj bakarnih i nikalnih ruda, ili u aluvijalnim ležištima. Četvrtina svih platinskih metala otpada na platinu. Upotrebljava se za izradu aparatura otpornih na koroziju, za izradu nakita i električnih kontakata. Skoro četvrtina proizvodnje platine se troši na katalizatore.
plutonij → plutonium
Plutonij su 1940. godine otkrili Glenn T. Seaborg Seaborg, Edwin M. McMillan, J. W. Kennedy i A. C. Wahl (USA). Ime je dobio po planetu Plutonu. To je sintetski radioaktivni srebrni metal. Reagira s kisikom iz zraka, kiselinama i vodenom parom. Otporan je na lužine. Plutonij je visokotoksičan element i ima ekstremno nisku dopuštenu dozu izloženosti. Plutonij se pripravlja u nuklearnim reaktorima bombardiranjem urana s neutronima, odnosno radioaktivnim raspadom neptunija-239. Služi kao fisijski materijal.
otrov → poison
Otrovi su tvari koje kontaktom ili unošenjem u organizam slabe ili onemogućavaju normalne metaboličke procese i tako mijenjaju normalno funkcioniranje organa ili tkiva
Otrovi su tvari ili molekule koje se skupljaju na površini katalizatora i time blokiraju pristup aktivnim centrima ili uništavaju njihovu aktivnost.
Otrovi su tvari koje apsorbiranjem neutrone i time smanjuju nuklearnu reakciju. Prevelika količina otrova može potpuno zaustaviti lančanu reakciju.
polidentantni liganad → polydentant ligand
Polidentantni liganadi sadrže više koordinacijskih mjesta (mogu dati više elektronskih parova) i grade komplekse prstenaste strukture (kelatne komplekse) zamjenjujući dva ili više monodentantna liganda. Takav ligand je EDTA koja ima 6 koordinacijskih mjesta i gradi s metalima komplekse uvijek u odnosu 1:1.
polimorfija → polymorphism
Polimorfija je pojavljivanje čvrste tvari u više inačica s različitim kristalnim strukturama. Različiti polimorfi imaju različite rasporede atoma unutar jedinične ćelije i imaju različita fizikalna svojstva. Prema broju polimorfa razlikujemo dimorfiju, trimorfiju itd. Kalcijev karbonat je dimorfan jer kristalizira heksagonski kao kalcit i rompski kao aragonit. Prevladavajuća kristalna struktura ovisi o temperaturi i tlaku.
Željezo je metal s polimorfnom strukturom. Svaka struktura je stabilna u određenom rasponu temperatura, na primjer, do temperature 912 °C željezo ima bcc kristalnu strukturu (α-željezo ili ferit). U temperaturnom području između 912 C i 1 394 °C kristalizira u fcc kristalnoj rešetki (γ-željezo ili austenit), a pri temperaturi 1 394 °C ponovo dolazi do polimorfne promjene iz fcc u bcc kristalnu strukturu (δ-željezo) koju zadržava do tališta.
Polimorfiju među elementima nazivamo alotropija.
Citiranje ove stranice:
Generalić, Eni. "Meta position." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav