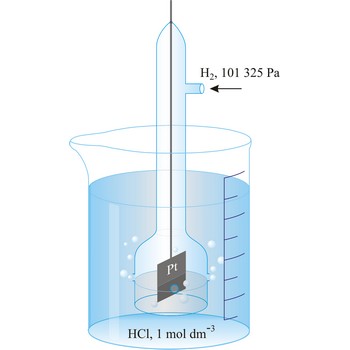
standardna vodikova elektroda → standard hydrogen electrode
Standardna vodikova elektroda sastoji se od elektrode od spužvaste platine uronjene u otopinu vodikovih iona aktiviteta 1 kroz koju se propušta plinoviti vodik pod tlakom od 101 325 Pa. Standardna vodikova elektroda u članku dogovorno se prikazuje uvijek lijevo
Redoks-potencijal standardne vodikove elektrode, pri svim temperaturama, dogovorno je uzet kao 0.
CO2 ion selektivna elektroda → CO2 ion selective electrode
Ion selektivna elektroda za mjerenje koncentracije ugljikovog dioksida koristi hidrofobnu, CO2 propusnu membranu koja odvaja unutrašnju otopinu od otopine uzorka. Otopljeni ugljikov dioksid iz uzorka prolazit će kroz membranu sve dotle dok se ne uspostavi ravnoteža između parcijalnih tlakova CO2 u vanjskoj i unutrašnjoj otopini. Difuzija CO2 kroz membranu utječe na koncentraciju hidronijevog iona u unutrašnjoj otopini prema reakciji
Koncentracija H+ iona u unutrašnjoj otopini mjeri se staklenom elektrodom. Unutrašnja otopina sadrži visoku koncentraciju natrijeva bikarbonata (npr. 0.1 mol/L NaHCO3) kako bi količina bikarbonata ostala konstantna tijekom mjerenja.
elektrodepozicija → electrodeposition
Elektrodepozicija, odnosno elektrotaloženje postupak je taloženja čvrstog materijala na elektrodnu površinu elektrolizom. Postoji jako puno postupaka elektrodepozicije metala. Ovaj postupak ne koristi se samo za elektrodepoziciju metala nego i za formiranje oksida anodnom oksidacijom (npr. magnezijev oksid i olovni(IV) oksid).
elektrodijaliza → electrodialysis
Elektrodijaliza je postupak dijalize ubrzan djelovanjem električnog polja. Dijalizator je podijeljen u tri dijela. Otopina koja se dijalizira teče kroz srednji odjeljak, između dviju polupropusnih membrana za pozitivne i negativne ione. Elektrode su smještene u pokrajnje odjeljke. Pod utjecajem električnog polja pozitivni ioni putovat će prema katodi (negativnoj elektrodi), a negativni ioni prema anodi (pozitivnoj elektrodi) čime se ubrzava putovanje iona kroz membranu. Tijekom dijalize čista voda nakuplja se uz elektrode a između membrana ostaje slana.
potenciometrijska titracija → potentiometric titration
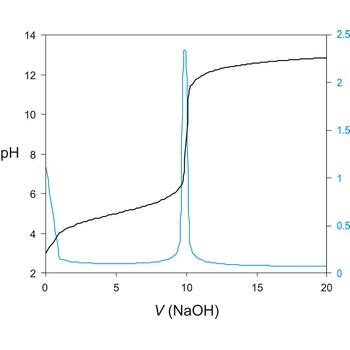
Potenciometrijska titracija je volumetrijska metoda kojom se mjeri potencijal između dvije elektrode (referentne i indikatorske elektrode) kao funkcija dodanog volumena reagensa. Temeljni princip potenciometrijske titracije je određivanje nepoznate koncentracije ispitivane otopine titracijom s nekom standardnom otopinom pri čemu skokovita (nagla) promjena potencijala indikatorske elektrode ukazuje i određuje završnu točku titracije.
Instrumentalno određivanje završne točke ima niz prednosti u odnosu na korištenje indikatora. Vizualno određivanje završne točke opterećeno je subjektivnim faktorima, a ne može se koristiti u mutnim i obojenim otopinama. Potenciometrijske metode određivanja završne točke mogu se primijeniti, ne samo za kiselo-bazne titracije već i kod taložnih, redoks i drugih titracija.
Titracijska krivulja ima karakterističan sigmoidalni oblik. Dio krivulje s maksimalnom promjenom potencijala je ekvivalentna točka titracije. Točku ekvivalencije možemo točnije odrediti iz diferencijalne krivulje ΔE/ΔV gdje maksimum krivulje određuje točku ekvivalencije.
kiselina → acid
Kiseline su vrsta spojeva koji sadrže vodik i disocijacijom u vodi daju pozitivne vodikove ione pri čemu je rezultirajući pH manji od 7. Reakcija za kiselinu HA može se napisati kao
Ustvari, vodikov je ion (proton) solvatiziran pa reakcija disocijacije kiseline izgleda ovako:
Ova definicija kiselina dolazi iz Arrheniusove teorije. Kiseline su tvari čije vodene otopine imaju kiseli okus, korozivne su i mijenjaju boju lakmus-papira u crvenu.
Kiseline možemo podijeliti na jake, koje potpuno disociraju u vodi (npr. sulfatna i kloridna kiselina), i slabe kiseline, koje su samo djelomično disocirane (npr. octena i sumporvodična kiselina). Jakost kiseline ovisi o stupnju disocijacije i izražava se konstantom disocijacije kiseline.
Arrheniusovu definiciju kiselina i baza proširili su J. M. Lowry i J. N. Brønsted 1923. Njihova teorija definira kiselinu kao tvar koja daje proton (proton donor), a bazu kao tvar koja je sposobna primiti proton (proton akceptor). Da bi se neka jedinka ponašala kao kiselina, mora biti prisutan proton akceptor (baza). Lowry-Brønstedova teorija kaže da kad neka kiselina dade proton, nastane konjugirana baza koja može primiti proton.
Prema Lowry-Brønstedovoj predodžbi, kad neka kiselina dade proton, uvijek nastane konjugirana baza koja može primiti proton.
Slično, od svake baze kao rezultat primitka protona nastane konjugirana kiselina.
Primjerice, acetatni ion je konjugirana baza octene kiseline, a amonijev ion je konjugirana kiselina amonijaka.
Što je kiselina konjugiranog kiselo/baznog para slabija, njezina konjugirana baza postaje jača, i obrnuto.
Najopćenitiju definiciju kiselina dao je G. N. Lewis koji sve kemijske vrste koje mogu primiti elektronski par naziva kiselinama. Ova definicija uključuje sve "tradicionalne" kiselo-bazne reakcije, ali sadrži i reakcije koje ne uključuju ione, primjerice
u kojoj je NH3 baza (donor elektronskog para) a BCl3 kiselina (akceptor elektronskog para).
elektromotorna sila → electromotive force
Elektromotorna sila (e.m.f. ili EMF ili EMS) razlika je potencijala između dviju različitih elektroda koje su uronjene u isti elektrolit ili između dvaju polučlanaka spojenih elektrolitnim mostom.
Faradejska reakcija → Faradaic reaction
Faradejska reakcija je heterogena reakcija prijenosa naboja koja se odvija na elektrodnoj površini.
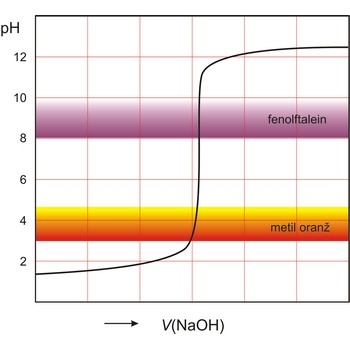
kiselo-bazna titracija → acid-base titration
Kiselo-bazna titracija analitička je tehnika koja se koristi kod volumetrijske analize gdje se kiselina poznate koncentracije koristi pri neutralizaciji lužine poznatog volumena, zatim se utrošeni volumen kiseline koristi da bi se odredila nepoznata koncentracija baze. Prilikom kiselo-bazne titracije koristi se kiselo-bazni indikator da bi se mogla odrediti završna točka titracije.
Citiranje ove stranice:
Generalić, Eni. "Indicator electrode." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav