elektrodepozicija → electrodeposition
Elektrodepozicija, odnosno elektrotaloženje postupak je taloženja čvrstog materijala na elektrodnu površinu elektrolizom. Postoji jako puno postupaka elektrodepozicije metala. Ovaj postupak ne koristi se samo za elektrodepoziciju metala nego i za formiranje oksida anodnom oksidacijom (npr. magnezijev oksid i olovni(IV) oksid).
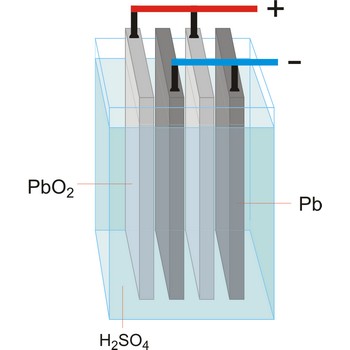
elektrolitska ćelija → electrolytic cell
Elektrolitska ćelija je ćelija u kojoj se električna energija pretvara u kemijsku. Kemijske reakcije se ne dešavaju spontano, već se odvijaju na račun struje koju u ćeliju šalje vanjski izvor i vrši elektrolizu. Promjena slobodne Gibbsove energije ukupnog procesa pozitivna je. Koriste se za elektrolizu tvari ili za spremanje električne energije pretvorbom u kemijsku (akumulatori).
galvaniziranje → electroplating
Galvaniziranje je postupak nanašanja metalne prevlake na predmet upotrebom elektrolize. Predmet se uroni u otopinu koja sadrži sol metala koji se nanaša i spoji na negativni pol baterije. Pozitivni metalni ioni putuju prema katodi (predmetu) na kojoj se reduciraju do elementarnog stanja stvarajući na predmetu tanki metalni film.
Primjerice, posrebrenjivanje mesinganih ili niklenih predmeta radi se u otopini srebrovih iona. Predmeti se spoje kao katoda i urone u otopinu a kao anoda uzme se čistog srebro. Otopina je smjesa srebrova nitrata i kalijeva cijanida koji smanjuje koncentraciju srebrovih iona čime se poboljšava kvaliteta galvaniziranja. Reakcije na elektrodama su:
fluor → fluorine
Fluor je 1886. godine otkrio Henri Moissan (Francuska). Ime mu dolazi od latinske riječi fluere što znači teći jer se njegov mineral fluorit (CaF2) upotrebljavao za snižavanje točke topljenja. To je svjetložuti do zelenkasti plin s oštrim nadražujućim mirisom. Najreaktivniji je od svih elemenata i može oksidirati gotovo sve što dođe s njim u dodir. Fluor je jako otrovan plin. Nadražuje na dodir. U prirodi se pojavljuje samo u spojevima, od kojih su najvažniji fluorit (CaF2), kriolit (Na3AlF6) i fluorapatit (Ca5(PO4)3F). Dobiva se elektrolizom kalij fluorida u bezvodnom fluorovodiku. Primjenjuje se za punjenje rashladnih uređaja (freon) i polimerizaciju u politetrafluoretilen (PTFE).
teška voda → heavy water
Molekule vode sastavljene su od dva atoma vodika i jednog atoma kisika (H2O). Ako se vodikovi atomi u molekuli vode zamijene s deuterijevim atomima nastat će teška voda (D2O). Deuterij se razlikuje od vodika po tome što ima jedan neutron više u jezgri atoma. Udio teške vode u normalnoj vodi je približno 1:5000 i može se koncentrirati elektrolizom. Teška voda ima i više vrelište (101.4 °C) i više ledište (3.6 °C) od normalne vode. Teška voda je 1.11 puta (20/18=1.11) teža od obične vode.
vodik → hydrogen
Vodik je 1766. godine otkrio Sir Henry Cavendish (Engleska). Ime mu je dao Lavoisie od grčkih riječi hydro što znači voda i genes što znači tvoriti. To je plin bez boje i mirisa, netopljiv u vodi. Lako difundira kroz sve materijale. Zapaljiv je i pravi eksplozivne smjese u zraku. Zapaljen na zraku gori svijetlim vrućim plamenom dajući vodenu paru. Na povišenoj temperaturi lako se spaja s kisikom, sumporom i halogenim elementima. Procjenjuje se da 90 % svih atoma, odnosno skoro 3/4 mase svemira, otpada na vodik. Sve zvijezde, pa i Sunce, sastavljene su uglavnom od vodika (w>90 %). Vodik se u prirodi rijetko nalazi u elementarnom stanju, samo u višim slojevima atmosfere ili u vulkanskim plinovima. Uglavnom je vezan u spojevima od kojih su najrašireniji voda (H2O), amonijak (NH3) i razni organski spojevi. Čisti vodik se najčešće dobiva elektrolizom vode. Laboratorijski se dobiva reakcijom sulfatne kiseline i elementarnog cinka. Industrijski se dobiva prevođenjem vodene pare preko užarenog koksa. Upotrebljava se za sintezu amonijaka, hidriranje ugljena i ulja, proizvodnju kloridne kiseline i kao redukcijsko sredstvo.
magnezij → magnesium
Magnezij je 1808. godine otkrio Sir Humphry Davy (Engleska). Ime mu potječe od grčkog naziva za magnezijev oksid (MgO) - magnesia alba, prema okrugu u Thessaly, Grčka. To je polutvrdi, sjajni, srebrno bijeli metal, koji na zraku potamni zbog zaštitne prevlake oksida. Može se kovati, lijevati i valjati. Gori na zraku uz pojavu vrlo intenzivne svjetlosti. Lako se otapa u kiselinama a reagira i s vodom na povišenim temperaturama uz oslobađanje vodika. Magnezij se upotrebljava kao snažno redukcijsko sredstvo koje može reducirati mnoge metalne okside. Najvažniji izvor magnezija su minerali dolomit (CaCO3·MgCO3) i magnezit (MgCO3), te morska voda. Glavno područje primjene magnezija je metalurgija, posebno za izradu lakih legura.
neodimij → neodymium
Neodimij je 1885. godine otkrio Carl F. Auer von Welsbach (Austrija). Ime je dobio po grčkim riječima neo i didymos što znači novi blizanac. To je srebrno bijeli metal koji brzo potamni na zraku. Sporo reagira s hladnom vodom, a mnogo brže s toplom. Zapali se na zraku kada se zagrije i izgara do Nd2O3. Glavni izvor lakih lantanoida je mineral monacit (Ce, La, Nd, Pr fosfat) koji se nalazi u monacitnim pijescima. Koristi se za izradu piroforne legure od koje se rade kremenčići za upaljače. Boji staklo od čisto ljubičaste do vinsko crvene. Staklo koje sadrži neodimij može se upotrebljavati za lasere i u astronomiji.
kisik → oxygen
Kisik je 1774. godine otkrio Joseph Priestley (Engleska). Ime mu je dao Lavoisiera od grčke riječi oxys što znači oštar ili kiseo i riječi genes što znači tvoriti. To je plin bez boje i mirisa i ekstremno je reaktivan. Stvara okside sa svim ostalim elementima izuzev plemenitih plinova. Kisik je nezapaljivi plin ali podržava gorenje. Nešto je teži od zraka i dobro se otapa u vodi, topljivost mu je oko 3 % (volumna). Javlja se u dvije alotropske modifikacije, kao dvoatomna i kao troatomna molekula (ozon). I jedna i druga su jaka oksidacijska sredstva. Topljivost ozona u vodi je gotovo 50 puta veća nego topljivost dvoatomnog kisika. Kisik je najrasprostranjeniji element Zemljine kore. Skoro polovica mase je kisik, a po broju atoma je brojniji nego svi ostali elementi zajedno. Kisik se industrijski dobiva ili frakcijskom destilacijom ukapljenog zraka ili elektrolizom vode. Najčešće se upotrebljava kao oksidacijsko sredstvo.
srebrni kulometar → silver coulometer
Srebrni kulometar jedan je od najtočnijih kulometara. Sastoji se od platinskog lončića koji djeluje kao katoda. U lončiću je otopina čistog srebrovog nitrata (c(AgNO3) = 1 mol/L). Anoda je štap od čistog srebra i nalazi se u poroznoj posudi koja sprječava da čestice koje se otkinu s anode dođu do katode. Gustoća struje na anodi ne bi smjela prijeći 0.2 Acm-2. Vaganjem platinskog lončića prije i poslije elektrolize dobije se masa srebra i iz nje se izračuna količina elektrike koja je prošla kroz kulometar (količina elektrike od 96500 C izluči 107.88 g srebra).
Citiranje ove stranice:
Generalić, Eni. "Electrolysis." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav