salinitet → salinity
Salinitet (S) je mjera za količinu otopljenih soli u morskoj vodi. Salinitet je definiran kao ukupna količina otopljenih soli u morskoj vodi u promilima, ‰, (djelovima na tisuću) kada se svi karbonati pretvore u okside, bromidi i jodidi u kloride i kada se sve organske tvari kompletno oksidiraju.
Klorinitet je najstarija metoda za mjerenje saliniteta koja, temeljem ideje o stalnom omjeru otopljenih komponenti morske vode, pruža uvid u ukupnu količinu otopljenih soli u morskoj vodi mjerenjem koncentracije halida (klorida, bromida i jodida). Odnos između kloriniteta (Cl) i saliniteta dan u Knudsenovim tablicama jest
Ova formula koristila se do 1962., kada je JPOTS (Joint Panel for Oceanographic Tables and Standards) odredilo novu konstantu proporcionalnosti u Knudsenovoj formuli
U međuvremenu, razvoj uređaja za mjerenje električne vodljivosti doveo je do brze, jeftine i precizne metode za određivanja slanosti morske vode. Uveden je Praktični salinitet (SP) kao zamjena za salinitet dobiven mjerenjem kloriniteta. Skala praktičnog saliniteta (Practical Salinity Scale 1978, PSS-78) definirana je preko K15, odnosno odnosa električne vodljivosti uzorka mora pri t68 = 15 °C i tlaku od jedne standardne atmosfere i otopine kalijevog klorida (KCl) u kojoj je maseni udio KCl točno 0.0324356 (32.4356 g KCl otopljeno je u 1 kg otopine) pri istom tlaku i temperaturi.
Praktični salinitet je bezdimenzijska veličina iako mu ponekad (pogrešno) pripisuju jedinicu "psu". U većini slučajeva može se pretpostaviti da su psu i ‰ sinonimi.
Prosječni salinitet morske vode je 35 ‰, što je oko 35 g soli otopljeno u 1 kg morske vode.
superoksid → superoxide
Superoksidi binarni su spojevi koji sadrže kisik sa stupnjem oksidacije -½. Superoksidni ion, O2-, ima nespareni elektronski par i vremenom se spontano disproporcionira u peroksid. Teži alkalijski elementi (K, Rb, Cs) stvaraju superokside direktnim spaljivanjem na zraku (KO2, RbO2, CsO2). To su žuto do narančasto obojeni paramagnetični spojevi. Superoksidi su jaki oksidansi koji burno hidroliziraju dajući peroksid i elementarni kisik.
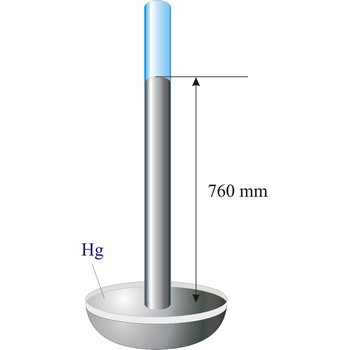
Torricelli, Evangelista → Torricelli, Evangelista
Evangelista Torricelli (1852.-1908.) je talijanski fizičar i matematičar. On je prvi uspio stvoriti stalni vakuum i izumio je barometar (1643.). Staklenu cijev, zatvorenu na jednom kraju, napunio je živom i pažljivo uronio otvorenim krajem u posudu sa živom. Živa u cijevi se spustila ostavljajući vakuum u cijevi iznad nje. Otkrio je da visina stupca žive varira ovisno o atmosferskom tlaku. Također je konstruirao brojne i kvalitetne leće.
U-manometar → U-tube manometer
U-manometar je staklena u cijev napunjena vodom ili živom i koristi se za mjerenje tlaka. Tlak se mjeri tako da se jedan njen kraj priključi na prostor u kojemu treba izmjeriti tlak (P), a na drugom je kraju poznati tlak (Pref), obično atmosferski tlak (cijev je otvorena prema okolišu). Ako je tlak u promatranom prostoru veći od okolišnoga tlaka, u tom se dijelu U-cijevi stupac kapljevine spusti, a u suprotnom podigne.
Ako je fluid C atmosferski zrak, fluid B tekućina u cijevi (npr. voda ili živa) a fluid A plin koji ispitujemo tada je ρB >> ρA, ρC. Tlak uzrokovan masom plina u cijevi može se zanemariti pa se nepoznati tlak plina može izračunati pomoću jednadžbe:
van der Waalsova jednadžba → van der Waals’ equation
Van der Waalsova jednadžba jest jednadžba stanja za realne plinove koja ima oblik:
gdje je P tlak, Vm je molarni volumen, T je temperatura, R je molarna plinska konstanta, a i b su karakteristični parametri tvari koji opisuju učinak privlačnih i odbojnih intermolekularnih sila.
Zieglerov proces → Ziegler process
Zieglerov proces je industrijski proces za proizvodnju polietilena visoke gustoće upotrebom titanij(IV) klorida (TiCl4) i aluminij alkila (npr. trietilaluminija, Al(C2H5)3). Proces je predstavio 1953. njemački kemičar Karl Ziegler (1898.-1973.). Zieglerovim procesom proizvodio se polietilen kod nižih temperatura (oko 60 °C) i tlakova (oko 1 atm) nego u izvornom procesu.
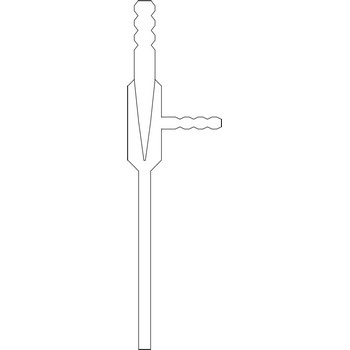
CO2 ion selektivna elektroda → CO2 ion selective electrode
Ion selektivna elektroda za mjerenje koncentracije ugljikovog dioksida koristi hidrofobnu, CO2 propusnu membranu koja odvaja unutrašnju otopinu od otopine uzorka. Otopljeni ugljikov dioksid iz uzorka prolazit će kroz membranu sve dotle dok se ne uspostavi ravnoteža između parcijalnih tlakova CO2 u vanjskoj i unutrašnjoj otopini. Difuzija CO2 kroz membranu utječe na koncentraciju hidronijevog iona u unutrašnjoj otopini prema reakciji
Koncentracija H+ iona u unutrašnjoj otopini mjeri se staklenom elektrodom. Unutrašnja otopina sadrži visoku koncentraciju natrijeva bikarbonata (npr. 0.1 mol/L NaHCO3) kako bi količina bikarbonata ostala konstantna tijekom mjerenja.
vodena sisaljka → water jet vacuum pump
Vodena sisaljka (aspirator) jedna je od najpopularnijih naprava za osiguravanje vakuuma u laboratoriju. Vodena sisaljka kao i sve mlazne vakuumske pumpe nema pokretnih dijelova, već na temelju podtlaka koji se stvara na mjestu suženja mlaza fluida (Venturijev efekt) usisava čestice plina ili tekućine i odnosi ih sa sobom do izlaza iz pumpe. Ovisno o području primjene mogu biti napravljene od stakla, plastike ili metala. Venturijev efekt nazvan je po talijanskom fizičaru Giovanni Battisti Venturi (1746–1822).
Schrotterova aparatura za određivanje CO2 → Schrotter apparatus for determination of CO2
Schrötterova aparatura za razgradnju (Schrötterov alkalimetar) koristi se za određivanje sadržaja karbonata u uzorcima vapnenca, gipsa, dolomita ili prašak za pecivo metodom gubitka težine. Aparaturu je osmislio 1871. austrijski kemičar Anton Schrötter von Kristelli (1802.-1875.). Težina ispunjene aparature manja je od 75 g (aparatura je visoka samo 16 cm) tako da se može vagati na analitičkoj vagi.
Procedura: U tikvicu C se kroz otvor D ubaci oko 0.5 g praškastog karbonatnog uzorka. Kolona za sušenje A napuni se do polovice koncentriranom sumpornom kiselinom (H2SO4) a lijevak B otopinom klorovodične kiseline (w(HCl) = 15 %). Sve zajedno se izvaže. Skinu se čepovi s oba dijela i polako, kapanjem, ispusti se HCl na uzorak. Iz razvijenog CO2 ukloni se voda prolaskom kroz koncentriranu H2SO4 u posudi A i suhi CO2 ispisti se u atmosferu. Kad se prestane razvijati CO2 tikvica se zagrije do otprilike 80 °C kako bi se istjerao sav zaostali CO2. Kroz gornji dio kolone za sušenje A lagano se isisava zrak pomoću vodene sisaljke sve dok se tikvica ne ohladi na sobnu temperaturu. Vrate se svi čepovi na svoje mjesto te se ponovno izvaže cijela aparatura. Gubitak mase jednak je količini ugljikovog dioksida oslobođenoj iz karbonata.
Citiranje ove stranice:
Generalić, Eni. "Critical pressure." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav