Haberov proces → Haber process
Haberov proces je industrijski postupak sinteze amonijaka iz dušika i vodika:
Reakcija je egzotermna i reverzibilna, tako da se prinos na amonijaku povećava na nižim temperaturama. Brzina reakcije je previše mala na normalnoj temperaturi, pa se reakcija provodi pri optimalnoj temperatura od oko 450 °C. U reakciji se kao katalizator koristi željezo s aluminijevim oksidom kao promotorom. Povišenjem tlaka reakcija se pomiče u smjeru nastajanja amonijaka, pa se koristi tlak od 250 atmosfera. Amonijak se uklanja iz reaktora čime se reakcija pomiče u smjeru nastajanja produkata. Kao izvor vodika u originalnom procesu koristio se vodeni plin, dok se danas koristi vodik dobiven reformiranjem zemnog plina.
Proces je vrlo važan jer je to jedini industrijski način fiksacije dušika iz zraka u svrhu dobivanja umjetnih gnojiva i eksploziva. Postupak je razvio 1908. njemački kemičar Fritza Haber (1868.-1934.), a za industrijsku primjenu prilagodio ga je Carl Bosh (1874.-1940.), te se postupak još naziva Haber-Boshov postupak.
polučlanak → half-cell
Polučlanak je dio galvanskog članka u kojem dolazi do oksidacije ili do redukcije elementa u dodiru s vodom ili vodenom otopinom jednog od njegovih spojeva.
vrijeme poluraspada → half-life
Za jednostavno radioaktivno raspadanje vrijeme poluraspada, t1/2, definirano je kao vrijeme potrebno da se aktivnost nekog radioaktivnog izotopa smanji na polovicu svoje prvobitne vrijednosti.
Što je brzina raspada veća, to je vrijeme poluraspada manje. Poluživot je karakteristično svojstvo za svaki radioaktivni izotop i neovisno je o početnoj količini radioaktivnog izotopa i uvjetima.
poluživot reaktanta → half-life of a reactant
Za danu reakciju poluživot, t1/2, reaktanta jest vrijeme potrebno da njegova koncentracija dosegne vrijednost koja je aritmetička sredina njegove početne i konačne (ravnotežne) vrijednosti.
Poluživot reaktanta konstantan je za reakcije prvog reda.
Poluživot reaktanta za reakcije drugog reda nije konstantan već ovisi, osim o konstanti k, i o početnoj koncentraciji reaktanta.
poluvalni potencijal → half-wave potential
Poluvalni potencijal (E1/2) je potencijal na kojem je struja polarografskog vala jednaka polovici difuzijske struje (id). Kod reverzibilnih sustava poluvalni potencijal karakterističan je za svaku ionsku vrstu pojedinog elementa (ali ovisi o sastavu otopine) pa se E1/2 može koristiti za kvalitativno određivanje (identifikaciju) elektroaktivnih vrsta.
halogenirani ugljikovodik → halocarbon
Halogenirani ugljikovodici su spojevi koji sadržavaju samo ugljik, jedan ili više halogena, i ponekad vodik, primjerice ugljikov tetraklorid ili tetraklorometan (CCl4), tetrabromometan (CBr4). Niži članovi različitih homolognih nizova koriste se kao sredstva za hlađenje, sredstva za gašenje požara i kao sredstva za pjenjenje poliuretanske pjene. Polimerizacijom halogeniranih ugljikovodika nastaju plastične mase koje karakterizira visoka kemijska otpornost, visoka električna otpornost i dobra toplinska stabilnost.
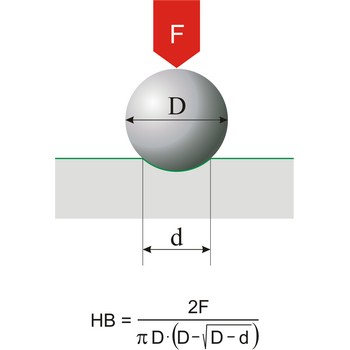
tvrdoća → hardness
Tvrdoća je otpor materijala prema utiskivanju tijela određene veličine, oblika i poznatog opterećenja. Ova se definicija odnosi na sve tipove skala tvrdoća osim Mohrove skale, koja je zasnovana na otpornosti na grebanje i koristi se uglavnom za minerale. Najčešće korištene skale tvrdoća su: Brinellova (za lijevano željezo), Rockwellova (za lim i toplinski obrađeni čelik) i Knoop (za metale).
poluacetal → hemiacetal
Poluacetali ili hemiacetali organski su spojevi opće formule R2C(OH)OR’ (R’ ≠ H) dobiveni adicijom molekule alkohola na karbonilnu skupinu aldehida ili ketona. Poluacetali su općenito nestabilni spojevi a stabilnija konfiguracija nastaje kada intramolekularnom ciklizacijom nastane peteročlani furanozni ili šesteročlani piranozni prsten. Prvotno se izraz poluacetali (hemiacetali) odnosio samo na poluacetale izvedene iz aldehida (jedan R = H) ali je danas proširen i na one izvedene iz ketona (poluketale) (oba R ≠ H).
poluketal → hemiketal
Poluketali ili hemiketali organski su spojevi opće formule R2C(OH)OR (R ≠ H) dobiveni adicijom molekule alkohola na karbonilnu skupinu ketona. Ako su keto i hidroksilna skupina u sastavu istog spoja, intramolekulskom ciklizacijom nastaje ciklički poluketal. Ovaj naziv bio je odbačen, ali je vraćen u upotrebu kao podklasa poluacetala.
Henryjev zakon → Henry’s law
Henryjev zakon formulirao je 1803. engleski kemičar William Henry (1775.-1836.). Sadržaj plina otopljenog u tekućini pri određenoj temperaturi upravo je razmjeran parcijalnom tlaku tog plina iznad tekućine. Henryjev zakon vrijedi samo za slabo topljive plinove pri niskim parcijalnim tlakovima.
gdje je pi parcijalni tlak komponente i iznad otopine, xi je molarni udio u otopini a Kx je konstanta karakteristična za dani plin i otapalo.
Citiranje ove stranice:
Generalić, Eni. "Clay triangle." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav