elektrodni potencijal → electrode potential
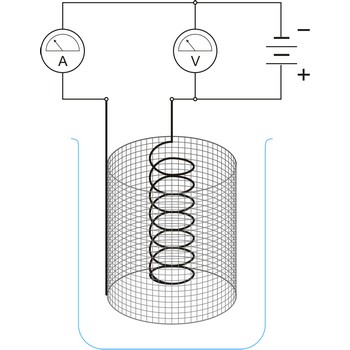
Elektrodni potencijal je potencijal elektrokemijske ćelije u kojoj je ispitivana elektroda spojena kao katoda a standardna vodikova elektroda (E = 0.000 V) kao anoda. Na katodi se uvijek događa redukcija a na anodi oksidacija.
Elektrodni potencijal je po definiciji redukcijski potencijal. Prema IUPAC-ovu dogovoru, izraz elektrodni potencijal namijenjen je isključivo za polureakcije napisane kao redukcije. Predznak elektrodnog potencijala određen je predznakom dotičnog polučlanka spojenog sa standardnom vodikovom elektrodom. Pozitivni predznak upućuje na to da je reakcija spontana u odnosu na standardnu vodikovu elektrodu, tj. da se polučlanak spontano ponaša kao katoda.
Članak za mjerenje elektrodnog potencijala sastoji se od standardne vodikove elektrode (dogovorno se piše lijevo)
i elektrode ispitivanog redoks-sustava (dogovorno se piše desno)
i može se shematski napisati kao
Elektromotorna sila (e.m.f.) ispitivanog redoks sustava jednaka je
Dogovorno je uzeto da je pri p(H2) = 101325 Pa i a(H+) = 1.00, potencijal vodikove elektrode jednak je 0.000 V pri svim temperaturama. Posljedica je takve definicije da se ukupni potencijal svakoga galvanskog članka koji sadrži standardnu vodikovu elektrodu pripisuje drugoj elektrodi
elektrodijaliza → electrodialysis
Elektrodijaliza je postupak dijalize ubrzan djelovanjem električnog polja. Dijalizator je podijeljen u tri dijela. Otopina koja se dijalizira teče kroz srednji odjeljak, između dviju polupropusnih membrana za pozitivne i negativne ione. Elektrode su smještene u pokrajnje odjeljke. Pod utjecajem električnog polja pozitivni ioni putovat će prema katodi (negativnoj elektrodi), a negativni ioni prema anodi (pozitivnoj elektrodi) čime se ubrzava putovanje iona kroz membranu. Tijekom dijalize čista voda nakuplja se uz elektrode a između membrana ostaje slana.
electrogravimetrija → electrogravimetry
Elektrogravimetrija je elektroanalitička tehnika kojom se tvar koja treba biti određena (obično metal) elektrodeponira na elektrodu izvaganu prije i poslije eksperimenta. Potencijal elektrode treba se pažljivo odabrati kako bi bili sigurni da će se na elektrodi istaložiti samo ona tvar koju određujemo.
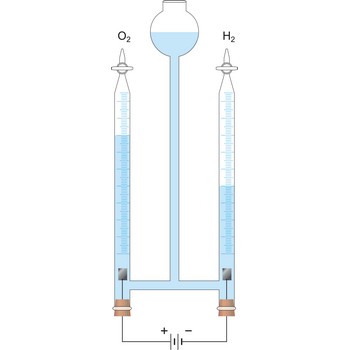
elektroliza → electrolysis
Elektroliza je elektrokemijski proces pri kojem se uz pomoć vanjskog izvora struje na elektrodama (katodi i anodi) vrše reakcije oksidacije i redukcije.
elektrolitska ćelija → electrolytic cell
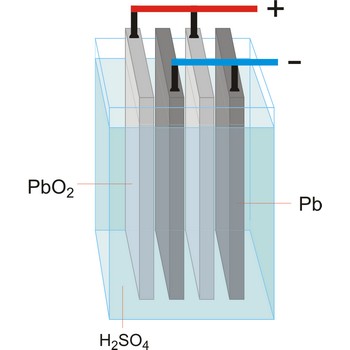
Elektrolitska ćelija je ćelija u kojoj se električna energija pretvara u kemijsku. Kemijske reakcije se ne dešavaju spontano, već se odvijaju na račun struje koju u ćeliju šalje vanjski izvor i vrši elektrolizu. Promjena slobodne Gibbsove energije ukupnog procesa pozitivna je. Koriste se za elektrolizu tvari ili za spremanje električne energije pretvorbom u kemijsku (akumulatori).
spektar elektromagnetskog zračenja → electromagnetic radiation spectrum
Valne duljine elektromagnetskih valova možemo prikazati pomoću spektra elektromagnetskih zračenja. Spektar elektromagnetskog zračenja podijeljen je na nekoliko područja od γ-zračenja vrlo kratkih valnih duljina i velike energije do radiovalova valnih duljina i preko 1 000 m. Ljudsko oko vidi samo uski dio elektromagnetskog spektra - vidljivo zračenje.
elektron → electron
Elektroni su elementarne čestice s negativnim električnim nabojem od (1.602 189 2±0.000 004 6)×10-19 C i 1/1837 mase protona, odnosno (9.109 534±0.000 047)×10-31 kg.
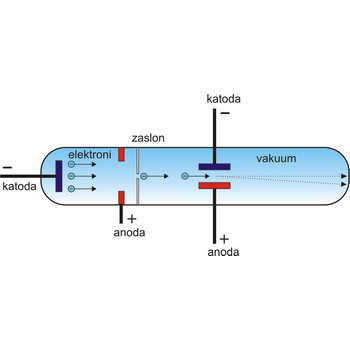
Elektron je 1897. otkrio engleski fizičar J.J. Thompson (1856.-1940.). On je ustanovio da prilikom provođenja elektrike kroz veoma razrijeđene plinove u Crookesovoj cijevi nastaju nevidljive zrake koje se od katode šire u pravcu i pod čijim utjecajem mnoge tvari fluoresciraju. Te zrake, katodne zrake, sastoje se od negativno nabijenih čestica koje se mogu skrenuti djelovanjem električnog i magnetskog polja.
Elektroni u atomu smješteni su u sedam ljuski oko jezgre, a maksimalni broj elektrona u svakoj ljusci ograničen je fizikalnim zakonima (2n2). Vanjska ljuska nije uvijek popunjena: natrij ima dva elektrona u prvoj ljusci (2×12 = 2), osam u drugoj (2×22 = 8) i samo jedan u trećoj ljusci (2×32 = 18). Elektron iz vanjske ljuske može prijeći u nepopunjenu ljusku drugog elementa ostavljajući atom pozitivno nabijenim. Valentni elektroni su oni elektroni koji mogu biti zarobljeni od drugog atoma ili dijeljeni s drugim atomom.
Elektroni mogu biti izbačeni iz atoma toplinom, svjetlošću, električnom energijom ili bombardiranjem visokoenergetskim česticama. Slobodni elektroni koji se spontano emitiraju raspadom radioaktivnih jezgri nazivaju se β-česticama.
elektronski afinitet → electron affinity
Elektronski afinitet je promjena energije koja se dešava kada atom, molekula ili radikal primi elektron. Za atom ili molekulu X može se reakcija pisati kao
Jedinica za elektronski afinitet jest kJ, ali se češće izražava u elektronvoltima.
Elektronski afinitet u istoj skupini opada s porastom atomskog broja, a u istoj periodi raste s porastom atomskog broja.
elektroforeza → electrophoresis
Elektroforeza je tehnika za analizu i separaciju koloida, temeljena na putovanju koloidnih iona pod utjecajem električnog polja. Pozitivne koloidne čestice putovat će prema katodi (negativnoj elektrodi), a negativne prema anodi (pozitivnoj elektrodi). Brzina migracije ovisit će o jakosti polja, naboju čestice i drugim faktorima, kao što su veličina i oblik koloidne čestice.
Veoma značajna je primjena elektroforeze u proučavanju bjelančevina (proteina), gdje se podešavanjem kiselosti otopine može kontrolirati brzina i smjer putovanja bjelančevine.
galvaniziranje → electroplating
Galvaniziranje je postupak nanašanja metalne prevlake na predmet upotrebom elektrolize. Predmet se uroni u otopinu koja sadrži sol metala koji se nanaša i spoji na negativni pol baterije. Pozitivni metalni ioni putuju prema katodi (predmetu) na kojoj se reduciraju do elementarnog stanja stvarajući na predmetu tanki metalni film.
Primjerice, posrebrenjivanje mesinganih ili niklenih predmeta radi se u otopini srebrovih iona. Predmeti se spoje kao katoda i urone u otopinu a kao anoda uzme se čistog srebro. Otopina je smjesa srebrova nitrata i kalijeva cijanida koji smanjuje koncentraciju srebrovih iona čime se poboljšava kvaliteta galvaniziranja. Reakcije na elektrodama su:
Citiranje ove stranice:
Generalić, Eni. "Clay triangle." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav