otvoreni sustav → open system
Otvoreni sustav je sustav koji može tvari i energiju izmjenjivati s okolinom.
Paulingova skala → Pauling scale
Paulingova skala je numerička skala elektronegativnosti temeljena na računanju energije veze kovalentno vezanih elemenata. Elektronegativnost je sila kojom atom privlači zajednički elektronski par. Fluorid je najelektronegativniji element i ima vrijednost 4 na Paulingovoj skali.
elektron → electron
Elektroni su elementarne čestice s negativnim električnim nabojem od (1.602 189 2±0.000 004 6)×10-19 C i 1/1837 mase protona, odnosno (9.109 534±0.000 047)×10-31 kg.
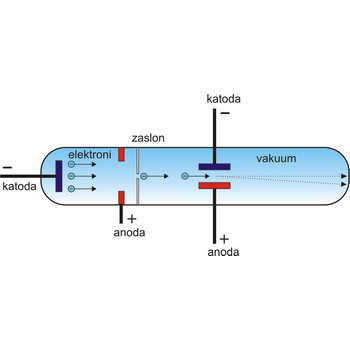
Elektron je 1897. otkrio engleski fizičar J.J. Thompson (1856.-1940.). On je ustanovio da prilikom provođenja elektrike kroz veoma razrijeđene plinove u Crookesovoj cijevi nastaju nevidljive zrake koje se od katode šire u pravcu i pod čijim utjecajem mnoge tvari fluoresciraju. Te zrake, katodne zrake, sastoje se od negativno nabijenih čestica koje se mogu skrenuti djelovanjem električnog i magnetskog polja.
Elektroni u atomu smješteni su u sedam ljuski oko jezgre, a maksimalni broj elektrona u svakoj ljusci ograničen je fizikalnim zakonima (2n2). Vanjska ljuska nije uvijek popunjena: natrij ima dva elektrona u prvoj ljusci (2×12 = 2), osam u drugoj (2×22 = 8) i samo jedan u trećoj ljusci (2×32 = 18). Elektron iz vanjske ljuske može prijeći u nepopunjenu ljusku drugog elementa ostavljajući atom pozitivno nabijenim. Valentni elektroni su oni elektroni koji mogu biti zarobljeni od drugog atoma ili dijeljeni s drugim atomom.
Elektroni mogu biti izbačeni iz atoma toplinom, svjetlošću, električnom energijom ili bombardiranjem visokoenergetskim česticama. Slobodni elektroni koji se spontano emitiraju raspadom radioaktivnih jezgri nazivaju se β-česticama.
elektronegativnost → electronegativity
Elektronegativnost je snaga kojom atom pojedinog elementa privlači elektrone. Primjerice, u klorovodiku atom klora je mnogo negativniji od atoma vodika i molekula je polarna, s negativnim nabojem na atomu klora. Elementi s velikom elektronegativnošću lako tvore negativne ione.
L. Pauling je, određivanjem energije kemijske veze, dao svoju skalu relativnih elektronegativnosti. Na toj skali fluor ima najveću elektronegativnost (4), a francij najmanju (0.7).
Što atom ima veću elektronegativnost, to jače privlači elektrone, a što je veća razlika u elektronegativnosti između elemenata, to je veći stupanj ionskog karaktera veze između njihovih atoma. Kad je razlika u relativnoj elektronegativnosti 1.9, udio je ionskog karaktera veze oko 50 %.
savršeni kristal → perfect crystal
Savršeni kristal onaj je kristal koji ne sadrži nikakve defekte i nečistoće i sastavljen je od potpuno identičnih međusobno ponavljajućih podjedinica. Savršeni kristal ima samo jedan mogući raspored tako da svaka podjedinica ima jednak udio u ukupnoj energiji kristala.
Planckova konstanta → Planck constant
Planckova konstanta (h) jedna je od temeljnih prirodnih konstanti koja pomnožena s frekvencijom zračenja daje energiju sadržanu u jednom kvantu.
Njezina je vrijednost 6.626 075 5(40)·10-34 J s. Ime je dobila po njemačkom fizičaru Max Plancku (1858.-1947.).
entalpija → enthalpy
Entalpiju (H) uveo je J.W. Gibbs 1902. kao toplinsku funkciju stanja
gdje je U unutrašnja energija sustava, p je tlak a V volumen. U kemijskim reakcijama koje se odvijaju u atmosferi tlak ostaje konstantan i entalpija reakcije (ΔH) jednaka je
Za egzotermne reakcije ΔH je negativan.
entropija → entropy
Entropija (S) je termodinamička funkcija koja govori o iskoristivosti toplinske energije. Promjena entropije nekog sustava ovisi samo o početnom i konačnom stanju sustava i definirana je izrazom
Ako je sustav izoliran, njegova se entropija neće mijenjati kada se odvija reverzibilni proces, dok će rasti ako se odvija ireverzibilan (nepovratljiv) proces. Ireverzibilnost procesa mjeri se entropijom.
Najveću entropiju imaju plinovi a najmanju kristali. Prema tome, entropija se može smatrati mjerom za nered u nekom sustavu. Pri apsolutnoj nuli u savršenom kristalu entropija je jednaka nuli.
eksploziv → explosive
Eksplozivi (lat. explodere - raspasti se) su kemijski spojevi ili smjese koje zagrijavanjem, udarcem, trenjem ili inicijalnim paljenjem u veoma kratkom vremenskom razmaku oslobađaju veliku količinu energije. Kod gotovo svih eksploziva kemijska je reakcija trenutna oksidacija; potrebni kisik nalazi se u molekulama samog eksploziva, npr. sumpor i ugljen u crnom barutu izgaraju na račun kisika kojega u salitri (KNO3) ima oko 50 %. Stoga sumpor i ugljen izgaraju mnogo brže u barutu nego na zraku. Kod nitroglicerina prilikom eksplozije potreban kisik daju atomske grupe NO3-. Brzina izgaranja eksploziva određuje se vremenom koje je potrebno za izgaranje jednog komada eksploziva određene dužine i naziva se brzina detonacije (mjeri se u m/s). Eksplozija je egzotermna reakcija, tj. reakcija pri kojoj se razvija toplina. Ovako razvijena energija izaziva golem učinak zbog trenutačnosti reakcije. Eksplozivi se upotrebljavaju u razne svrhe: u građevinarstvu, rudarstvu i vojnoj industriji. Razne vrste eksploziva mogu se prema primjeni svrstati u tri kategorije: barute, brizantne eksplozive i inicijalne eksplozive.
Citiranje ove stranice:
Generalić, Eni. "Activation energy." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav