trojna točka → triple point
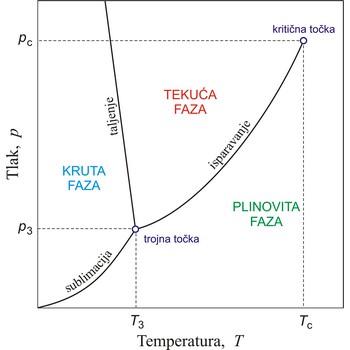
Trojna točka je točka u p,T prostor gdje su čvrsta, tekuća i plinska faza tvari u termodinamičkoj ravnoteži.
kritična točka → critical point
Kritična točka je točka na faznom dijagramu dvofaznog sustava u kojoj dvije faze imaju jednaka svojstva i zbog toga čine jednu fazu. U kritičnoj točki za tekuću i plinovitu fazu čiste tvari nestaje razlika između tekućine i plina i u njoj završava krivulja napona pare. Koordinate ove točke jesu kritična temperatura i kritični tlak. Iznad kritične temperature fluid se ne može ukapljiti.
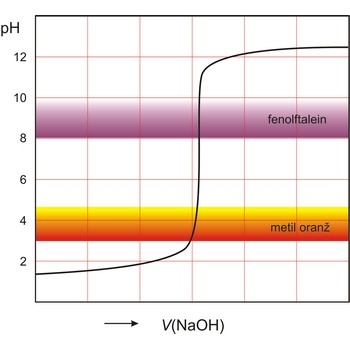
točka ekvivalencije → equivalence point
Točka ekvivalencije je točka pri titraciji kada je količina dodanog titranta ekvivalentna prisutnom analitu.
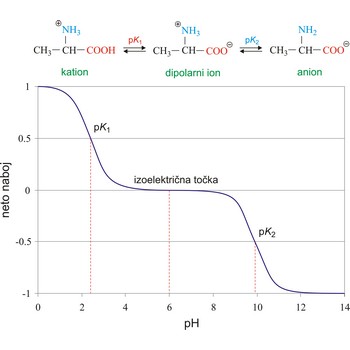
izoelektrična točka → isoelectric point
Izoelektrična točka (pI ili IEP) je pH otopine ili disperzije pri kojem je neto naboj molekule ili koloidne čestice jednak nuli. U izoelektričnoj točki aminokiseline ne putuju prema elektrodama pod utjecajem električnog polja. Neto naboj (algebarska suma svih nabijenih skupina prisutnih u dipolarnom ionu) aminokiselina, peptida i bjelančevina ovisi o pH vrijednosti otopine. Ispod izoelektrične točke aminokiseline adiraju protone i stvaraju katione a iznad izoelektrične točke se pretvaraju u anione. Primjerice, alanin može imati naboj +1, 0 ili -1 ovisno o pH vrijednosti medija u kojem je otopljen.
materijalna točka → point-like object
Materijalna točka je naziv za objekt (tijelo), uobičajen u kinematici. Dimenzije objekta kojeg zovemo materijalnom točkom, česticom ili sitnim tijelom možemo zanemariti pri proučavanju njegova gibanja.
kelvin → kelvin
Kelvin (K) je osnovna SI jedinica za termodinamičku temperaturu.
To je termodinamička temperatura koja je jednaka 1/273.16 termodinamičke temperature trojne točke vode. Trojna točka vode ona je vrijednost temperature i tlaka kod koje voda može postojati u sva tri agregatna stanja. Ime je dobila po engleskom znanstveniku sir W. Thompsonu, Lordu Kelvinu (1824.-1907.).
fazni dijagram → phase diagram
Ravnotežna stanja koja se uspostavljaju, pri određenim uvjetima, između pojedinih agregatnih stanja ili faza prikazuju se faznim dijagramom ili dijagramom stanja.
Krivulje na faznom dijagramu prikazuju ravnotežna stanja između dviju faza. Točku u kojoj su sve tri faze u ravnoteži nazivamo trojna točka. Krivulja isparavanja završava u kritičnoj točki. Iznad te temperature (kritična temperatura) ni u kojim uvjetima ne može se vodena para prevesti u tekuće stanje.
akceleracija → acceleration
Ako se brzina materijalne točke mijenja od neke početne vrijednosti, vp, u početnom trenutku tp do konačne vrijednosti, vk, u trenutku tk, srednja akceleracija, a definira se kao kvocijent promjene brzine, Δv=vk-vp, i vremenskog intervala, Δt=tk-tp, u kojemu je ta promjena nastala:
Trenutačna akceleracija, a, dobiva se kao granična vrijednost srednje akceleracije kad se Δt približava nuli:
Akceleracija je vektorska veličina. SI jedinica za akceleraciju je m s-2.
kiselo-bazna titracija → acid-base titration
Kiselo-bazna titracija analitička je tehnika koja se koristi kod volumetrijske analize gdje se kiselina poznate koncentracije koristi pri neutralizaciji lužine poznatog volumena, zatim se utrošeni volumen kiseline koristi da bi se odredila nepoznata koncentracija baze. Prilikom kiselo-bazne titracije koristi se kiselo-bazni indikator da bi se mogla odrediti završna točka titracije.
alotropija → allotropy
Alotropija (gr. allos, drugačije, and tropos, ponašanje) je pojavljivanje elemenata u dva ili više različitih molekulskih ili kristalnih oblika koji imaju različita kemijska i fizikalna svojstva. Razlika između ovih oblika može biti u njihovoj kristalnoj strukturi (bijeli, crveni i crni fosfor), broju atoma u molekuli (dvoatomni kisik i troatomni ozon) ili u molekularnoj strukturi kapljevine (tekući helij i helij II).
U nekim slučajevima alotropi su stabilni samo u određenom temperaturnom području koje je definirano temperaturom pretvorbe pri kojoj jedan alotrop prelazi u drugi. Primjerice, bijeli (metalni) kositar stabilan je ispod 13.2 °C a sivi (nemetalni) kositar stabilan je iznad 13.2 °C. Ova vrsta alotropije naziva se enantiotropija. Alotropija kod koje nema temperature (točke) pretvorbe naziva se monotropija.
Izraz alotropija ne može se primijeniti na tvari u različitim agregatnim stanjima, npr. kada se led topi i prelazi iz čvrstog leda u tekuću vodu.
Alotropija općenito opisuje pojavu polimorfizma kod elemenata, dok se polimorfija odnosi na svaku tvar koja može imati više kristalnih struktura.
Citiranje ove stranice:
Generalić, Eni. "Trojna točka." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav